
| A. | 硫酸(酸) | B. | 溶液(混合物) | C. | Al2O3(两性氧化物) | D. | 纯碱(碱) |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ①③ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
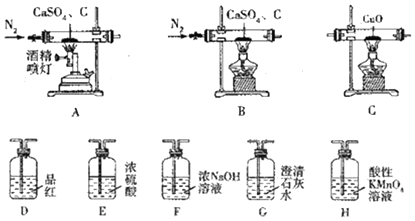
| 实验前 | 实验后 | |
| 实验1 | 装置C硬质玻璃管连同CuO质量为26.80g | 装置C硬质玻璃管连同反应后固体质量为26.64g |
| 实验2 | 装置G连同溶液质量为187.50g | 装置G连同反应后溶液及沉淀的质量为188.38g |
| 实验3 | 装置D、H连同溶液质量和为373.60g | 装置D、H连同溶液质量和为374.24g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
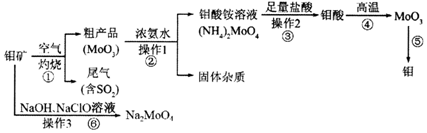
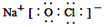 ;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O
;反应⑥生成三种钠盐,写出该反应的离子方程式:MoS2+OH-+ClO-=MoO42-+2SO42-+9Cl-+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中,KMnO4是还原剂 | |
| B. | 该反应中,C元素被氧化 | |
| C. | 通过该反应可知,氧化性:KMnO4>CO2 | |
| D. | 该反应每转移1mol电子,同时生成1molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2 | B. | Fe2O3、SiO2 | C. | SiO2、Al2O3 | D. | Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
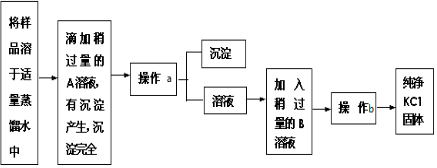
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向盛有0.5mol•L-1Fe(NO3)2溶液的试管中加入0.5mol•L-1H2SO4溶液 | 在试管口处出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向PbI2饱和溶液中滴加几滴0.1mol•L-1KI溶液 | 出现黄色沉淀 | 说明 PbI2饱和溶液中有Pb2+存在 |
| C | 向白色ZnS沉淀上滴加0.1mol•L-1CuSO4溶液,振摇 | 沉淀变为黑色 | ZnS沉淀转化为CuS沉淀 ZnS(s)+Cu2+(aq) ?CuS(s)+Zn2+(aq) |
| D | 相同条件下,用1mol•L-1醋酸溶液和1mol•L-1盐酸分别做导电性实验 | 醋酸溶液对应的灯泡较暗 | 醋酸是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com