
下列物质的除杂方 案正确的是( )
案正确的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | CO2 (g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
B | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C | KNO3(s) | NaCl(s) | AgNO3溶液 | 过滤 |
D | Cu(s) | Ag(s) | CuSO4溶液 | 电解法 |
科目:高中化学 来源:2016-2017学年河北省饶阳县高一上期中化学试卷(解析版) 题型:选择题
向含有KI、NaBr的混合溶液中通入过量的Cl2充分反应。将溶液蒸干并灼烧,最后剩余的固体物质是( )
A.KI和NaBr B.KCl和NaCl C.KCl和NaBr D.KCl、NaCl和I2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一上期中化学卷(解析版) 题型:选择题
下列电离方程式错误的是 ( )
A.NaHCO3 = Na++H++CO32- B.NaHSO4 = Na++H++SO42-
C.Mg(NO3)2 = Mg2++2NO3- D.Na2SO4 = 2Na++SO42-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1
C.+69.4 kJ·m ol-1 D.+45.2 kJ·mol-1
ol-1 D.+45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长株潭岳益五市十校高三12月联考化学卷(解析版) 题型:填空题
(1)汽车剧烈碰撞时,安全气囊中发生反应NaN3+KNO3→K2O+Na2O+X↑(未配平),已知X为单质,在反应中NaN3失去电子.则该反应的氧化剂为______,X的化学式为______.
(2)工业上制取高纯度MnO2的某一步骤如图所示:
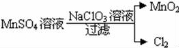
请写出该反应的离子方程式__ ___.
(3)草酸钙晶体(CaC2O4•H2O)可用作分离稀有金属的载体.
①在一定温度下向2L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s)?CaO(s)+CO(g)+CO2(g),若前5min内生成CaO的质量为11.2g,则该段时间内v(CO)=__________mol•L﹣1•min﹣1;当反应达到平衡后,将容器体积压缩到原来的一半,则下列说法正确的是__________(填答案选项编号).
A.平衡不移动,CaO的质量不变
B.平衡发生移动,且CaC2O4的分解率增大
C.平衡发生移动,但CO和CO2的浓度都没有改变
D.平衡向逆反应方向移动,且该反应的化学平衡常数减小
②某温度下,向0.3mol/L的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32﹣(aq)+CaC2O4(s)?CaCO3(s)+C2O42﹣(aq).静置后沉淀转化达到平衡.求此时溶液中的c(C2O42﹣)= mol•L﹣1.已知:该温度下,KSP(CaC2O4)=5.0×10﹣9;KSP(CaCO3)=2.5×10﹣9.
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长株潭岳益五市十校高三12月联考化学卷(解析版) 题型:选择题
下列关于有机物同分异构体的说法正确的是( )
A.C4H10的二氯取代物有4种
B.最简式为C2H5的烃结构简式有5种
C.乙苯的一氯 取代物只有3种
取代物只有3种
D.分子式为C4H10O且与钠反应的有机物有4种
查看答案和解析>>
科目:高中化学 来源:2017届湖北省八校高三上学期12月联考化学试卷(解析版) 题型:填空题
MnO2用途很广,它是一种广泛应用的氧化剂。例如将它加入熔态的玻璃中,可以除去带色的杂质(硫化物或亚铁盐),称为普通玻璃的“漂白剂”。在锰-锌干电池中用作去极剂,以氧化在电极上产生的氢。
(1)Zn- MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。其电解质溶液呈________性(填“酸”、“碱”或“中”),原因是_________________、________________(用离子方程式表示);该电池工作时,电子流向__________极(填“正”或 “负”)。
(2)工业上,常以菱锰矿(主要成分MnCO3,常含有少量铁、钙、锌等元素)为原料,用电解法可以制备MnO2。其制备过程如下:
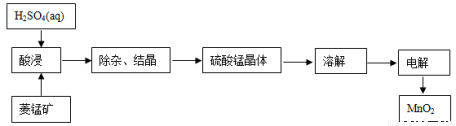
写出酸浸的主要化学方程式:______________________。
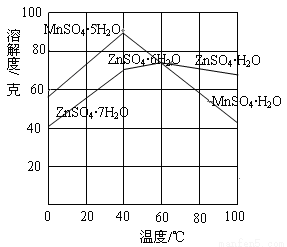
②下图可以看出,从MnSO4和ZnSO4混合溶液中结晶MnSO4·H2O晶体,需要控制的温度范围为______________(填字母)。
A.0~40℃ B.40~60℃ C.60℃以上
③请写出用惰性电极电解MnSO4溶液制备MnO2的阳极反应:___________________。
④该工艺产生的废水中含有较多的Mn2+,通常用H2S或者Na2S溶液处理。25 ℃,在0.10 mol·L-1 H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
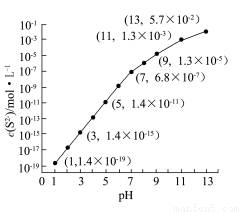
i.pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
ii.某溶液含x mol·L-1 Mn2+、0.10 mol·L-1 H2S,当调节溶液pH=5时,Mn2+开始沉淀,则x= 。[已知:Ksp(MnS)=2.8×10-13]
查看答案和解析>>
科目:高中化学 来源:2017届安徽省培优联盟高三冬季联赛化学试卷(解析版) 题型:选择题
常温下.用Na2S沉淀Cu2+、Mn2+、Fe2+、Zn2+四种金属离子(M2+),所需S2-最低浓度的对 数值lgc(S2-)与lgc(M2+)关系如下图所示,下列说法正确的是
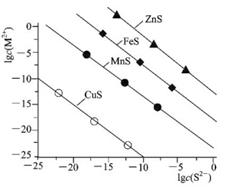
A.室温时.向ZnS悬浊液中加人ZnSO4固体,.Ksp(ZnS)将随之减小
B.Na2S溶液中:c(OH-)<c(H+)+c(HS-)+c(H2S)
C.为除去MnCl2溶液中混有的少量 CuCl2,可加入适量Na2S固体,充分搅拌后过滤
D.向100 mL浓度均为1×10-5mol/L的Fe2+、Zn2+混合溶液中逐滴加入1×10-4mol/LNa2S溶液,Fe2+先沉淀,证明Ksp(FeS)<Ksp(ZnS)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省分校高二上期中化学卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.标准状况下,22.4L二氯甲烷含有NA个二氯甲烷分子
B.1L 0.1mol/L乙酸溶液中H+数为0.1NA
C.17.6g丙烷中所含的极性共价键为3.2 NA个
D.1mol Na2O2 固体中含离子总数为4 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com