
【题目】Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用下图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是

A. 玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
B. c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
C. Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
D. e、f两管中的试剂可以分别是浓氨水和NaOH固体
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-484kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。

(1)通入足量SO2时C中观察到的现象为_____________________________。
(2)根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式______________________________;
②请设计实验方案检验有Fe2+生成_________________________。
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法_______(填“合理”或“不合理”),理由是____________
(3)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填序号)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作与说法正确的是( )

A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为醋酸,乙为贝壳(粉状),丙为苯酚钠溶液,则该装置不可以验证醋酸、碳酸、苯酚酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H3PO2是一元中强酸,写出其电离方程式_______________________________。NaH2PO2为__________(填“正盐”或“酸式盐”),其溶液显__________(填“弱酸性”、“中性”或“弱碱性”)
(2)下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
冷轧含锌废水水质 | 经处理后的水国家环保标准值 | |
Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
pH | 1~5 | 6~9 |
SO42-浓度/(mg·L-1) | ≤23000 | ≤150 |
经某一工艺处理后的废水pH=8,常温下,该废水中Zn2+的浓度为__________mg·L-1(常温下,Ksp[Zn(OH)2]=1.2×10-17),__________(填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2min B的浓度减少0.6 mol/L。有关反应速率的说法正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用A、B、C、D表示反应的速率,其比值是4:3:2:1
C. 2 min内的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液最好的方法是_______(写出具体实验操作,结论)。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:__________________________________。
(3)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是_____;
②溶液组成的测定:取50.0mL待测溶液,加入足量的AgNO3溶液,得到21.525g白色沉淀。则溶液中c(Cl-)=______mol/L。
③验证该溶液中是否含有Fe2+,正确的实验方法是_____________。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+
C.取适量溶液先滴入氯水再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
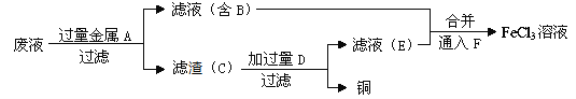
(4)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:
①滤渣C的化学式为_________________。
②加过量D发生反应的离子方程为_____________________________________。
③通入F发生反应的离子方程式为 ____________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下①6.72L CH4 ②3.01×1023个HCl分子③ 13.6g H2S ④0.2mol NH3, 下列对这四种气体的关系从大到小表达正确的是_____
a.体积②>③>①>④ b.密度②>③>④>①
c.质量②>③>①>④ d.氢原子个数①>③>④>②
(2)在标准状况下,CO和CO2的混合气体共39.2 L,质量为61 g。则其中CO2为________mol, CO占总体积的______(保留一位小数),混合气体的摩尔质量为_______(保留一位小数)。
(3)某混合气体中各气体的质量分数为:O232%,N228%,CO222%,CH416%,H22%,则此混合气体的平均摩尔质量为______(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com