
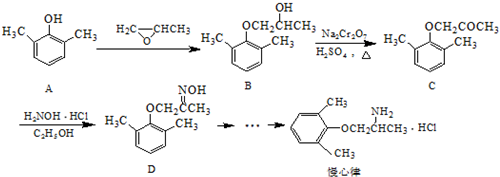
 .
.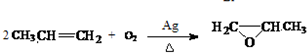 .
. .
. .
.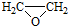 ).写出以邻甲基苯酚 (
).写出以邻甲基苯酚 (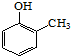 )和乙醇为原料制备
)和乙醇为原料制备 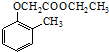 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2. 分析 (1)根据C的结构简式可知,C中含氧官能官为醚键和羰基;
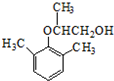
(2)对比A、B的结构可知属于加成反应;对比B、C结构可知,B中-CH(OH)-转化为C=O;
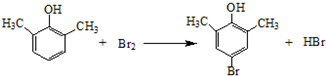
(3)A中含有酚羟基,酚羟基对位的苯环上有H,可与浓溴水发生取代反应;
(4)丙烯和氧气在银做催化剂并加热的条件下反应生成甲基环氧乙烷;
(5)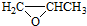 中含有2个C-O键,与A发生反应时可有两种不同的断裂方式;
中含有2个C-O键,与A发生反应时可有两种不同的断裂方式;
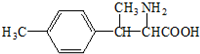
(6)D的一种同分异构体一种同时满足如下条件:①属于α-氨基酸,氨基、羧基连接同一碳原子上,②是苯的衍生物,且苯环上的一氯代物只有两种,可以是2个不同的取代基处于对位位置,③分子中含有两个手性碳原子,说明C原子上连接4个不同的原子或原子团;
(7)制备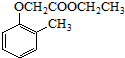 ,应先制备乙酸和
,应先制备乙酸和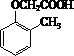 ,乙醇氧化可生成乙酸,乙醇消去可生成乙烯,乙烯氧化可生成
,乙醇氧化可生成乙酸,乙醇消去可生成乙烯,乙烯氧化可生成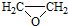 ,与
,与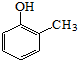 反应生成
反应生成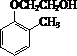 ,进而氧化可生成
,进而氧化可生成 ,再与乙醇发生酯化反应得到目标物.
,再与乙醇发生酯化反应得到目标物.
解答 解:(1)根据C的结构简式可知,C中含氧官能官为醚键和羰基,
故答案为:醚键、羰基;
(2)对比A、B的结构可知,A与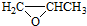 发生加成反应生成B;对比B、C结构可知,B中-CH(OH)-转化为C=O,属于氧化反应,
发生加成反应生成B;对比B、C结构可知,B中-CH(OH)-转化为C=O,属于氧化反应,
故答案为:加成反应;氧化反应;
(3)A中含有酚羟基,酚羟基对位的苯环上有H,可与浓溴水发生取代反应,反应方程式为: ,
,
故答案为: ;
;
(4)丙烯和氧气在银做催化剂并加热的条件下反应生成甲基环氧乙烷,反应方程式为: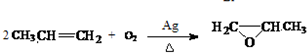 ,
,
故答案为: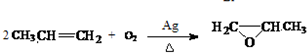 ;
;
(5)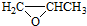 中含有2个C-O键,与A发生反应时可有两种不同的断裂方式,副产物E,它与B互为同分异构体,E的结构简式为
中含有2个C-O键,与A发生反应时可有两种不同的断裂方式,副产物E,它与B互为同分异构体,E的结构简式为 ,
,
故答案为: ;
;
(6)D的一种同分异构体一种同时满足如下条件:①属于α-氨基酸,氨基、羧基连接同一碳原子上,②是苯的衍生物,且苯环上的一氯代物只有两种,可以是2个不同的取代基处于对位位置,③分子中含有两个手性碳原子,说明C原子上连接4个不同的原子或原子团,符合条件的结构简式为: ,
,
故答案为: ;
;
(7)制备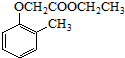 ,应先制备乙酸和
,应先制备乙酸和 ,乙醇氧化可生成乙酸,乙醇消去可生成乙烯,乙烯氧化可生成
,乙醇氧化可生成乙酸,乙醇消去可生成乙烯,乙烯氧化可生成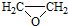 ,与
,与 反应生成
反应生成 ,进而氧化可生成
,进而氧化可生成 ,再与乙醇发生酯化反应得到目标物,合成路线流程图:
,再与乙醇发生酯化反应得到目标物,合成路线流程图: ,
,
故答案为: .
.
点评 本题考查有机物的合成、官能团结构与性质、限制条件同分异构体书写等,注意利用转化关系发生的反应类比设计合成路线,综合考查学生对知识的迁移应用、分析推理能力,难度中等.


科目:高中化学 来源: 题型:解答题
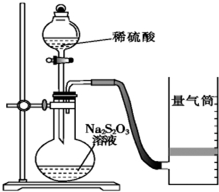 化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.
化学反应速率是描述化学反应进行快慢程度的物理量.下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由mXa+与nYb-得,m+a=n-b | |
| B. | 由mXa+与nYb-得X和Y不同周期 | |
| C. | X、Y一定不是同周期元素 | |
| D. | 若X离子是阴离子,则Y离子一定是阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水属于氧化物 | B. | 水分子中含有非极性键 | ||
| C. | 冰与可燃冰的化学成分完全相同 | D. | 氟气与水的反应中,水作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上大量使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 铝合金的大量使用是因为人们能用氢气等还原剂从氧化铝中获取铝 | |
| C. | 酸碱指示剂变色、煤的液化、海水提溴、皂化反应都涉及化学变化 | |
| D. | 金属镁着火可使用干粉灭火器灭火,但不可用泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y位于元素周期表的第2周期第IVA族 | |
| B. | X、Y、Z、W、M的原子半径由大到小的顺序为M>Y>Z>W>X | |
| C. | X、Z、W形成的盐中只含有离子键 | |
| D. | 产生刺激性气味气体的反应离子方程式为H++HSO3-=H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
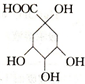
| A. | 1mol X能与5mol NaOH反应 | B. | X能发生加成、取代、氧化反应 | ||
| C. | X的分子式为C7H8O6 | D. | X与乙酸、乙醇均能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
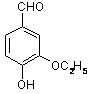 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.
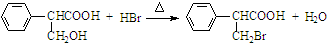 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).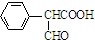 .
.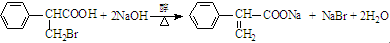 .
.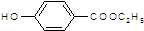 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用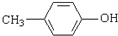 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).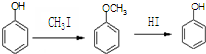
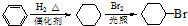
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
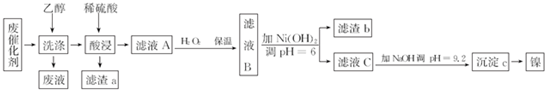
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com