


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| +D |
| 一定条件 |
| +D |
| 一定条件 |
| ||
| △ |
| ||
| △ |


| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属材料 | 环境 | 发生的主要腐蚀类别(填字母) |
| 钢铁管 | 输送石油 | |
| 镀锌水管(表层部分受损) | 输送自来水(pH=6~8) | |
| 镀锡铁桶(表层部分受损) | 露置在酸雨中 | |
| 铜火锅(碳合金) | 盛有食盐水 | |
| 铜银合金 | 浸泡在稀硫酸中 |
| 负极反应 | |
| 正极反应 | |
| 电化学总反应 | |
| 表层溶液中的反应 | |
| 最终生成铁锈的反应 | |
| 你提出解决防止“金字招牌”生锈的方案 |
查看答案和解析>>
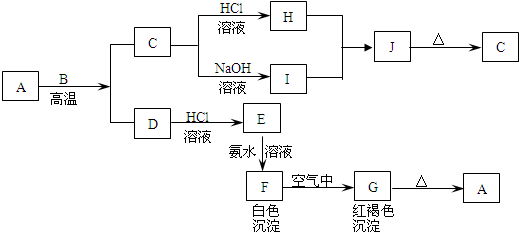
科目:高中化学 来源: 题型:
查看答案和解析>>
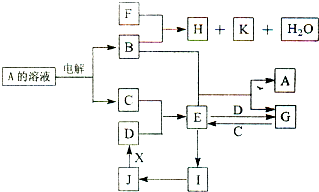
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(21分)金属M溶于稀HCl时生成氯化物,金属正离子的磁矩为5.0 B.M.。在无氧操作下,MCl2溶液遇NaOH溶液,生成一白色沉淀A。A接触空气,就逐渐变绿,最后变为棕色沉淀B。灼烧B生成了棕红色粉末C,C经不彻底还原生成了铁磁性的黑色物质D。
B溶于稀HCl生成溶液E,它能使KI溶液氧化为I2。
若向B的浓NaOH悬浮液中通入Cl2气可得一紫红色溶液F,加入BaCl2会沉淀出红棕色固体G,G是一种强氧化剂。
1.确定金属M及A~G,写出各反应方程式。
2.写出G与浓HCl反应的方程式及现象。
3.金属M单质可形成一系列的配合物,并且有如下转换反应:M(CO)5+![]()
![]() H
H![]() I
I![]() J,试确定H,I,J的结构式。
J,试确定H,I,J的结构式。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com