
由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)  CH3OH(g) +H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g) +H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+ H2(g)  CO (g)+H2O(g) △H2
CO (g)+H2O(g) △H2
反应Ⅲ:CO(g)+2 H2(g)  CH3OH(g) △H 3=-90.77 kJ•mol-1
CH3OH(g) △H 3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,反应Ⅲ自发进行条件是 (填“低温”、“高温”或“任何温度”)。
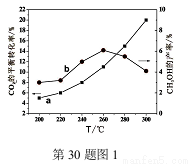
(2)某研究小组将一定量的H2和CO2充入恒容密闭容器中,在合适的催化剂条件下发生了反应I、Ⅱ、Ⅲ,不同温度下体系达到平衡时测得CO2的转化率(a)及CH3OH的产率(b)变化如图1所示。
①该反应达到平衡后,为再提高反应速率同时提高甲醇的生成量,可采取的措施有 。
A改用高效催化剂 B升高温度 C缩小容器体积 D分离出甲醇 E增加CO2的浓度
②据图1,当温度高于260℃时,CO2的平衡转化率随温度的升高继续增加,而CH3OH的产率却反而下降,请说明理由 。
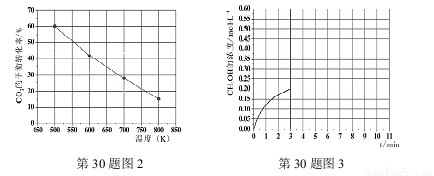
(3)已知:在2L恒容密闭容器中充入3mol H2和1.5mol CO2(一定条件下,仅考虑发生反应Ⅰ),实验测得在不同温度下,反应体系中CO2的平衡转化率与温度的关系曲线如图2所示。实验测得:在500K时,反应Ⅰ经10min时达到平衡,假如其他条件不变,当反应时间进行到3min时,迅速将反应温度升至600K进行实验,请在图3中画出3~10min内容器中CH3OH浓度的后续变化总趋势图。
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案科目:高中化学 来源:2016-2017学年湖南省高二上月考五化学卷(解析版) 题型:简答题
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
(1)在恒温,容积为1 L恒容中,硫可以发生如下转化,其反应过程和能量关系如图1所示(已知:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1),请回答下列问题:
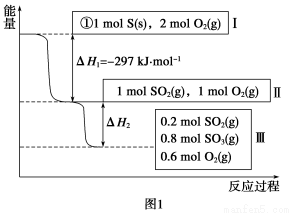
①写出能表示硫的燃烧热的热化学方程式:________。
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。
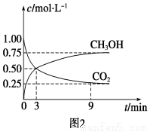
②能说明上述反应达到平衡状态的是________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3 mol H2,同时生成1 mol H2O
D.CO2的体积分数在混合气体中保持不变
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g)  CH3OH(g)的平衡常数。下列说法正确的是________。
CH3OH(g)的平衡常数。下列说法正确的是________。
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应ΔS<0
C.在T ℃时,1 L密闭容器中,投入0.1 mol CO和0.2 mol H2,达到平衡时,CO转化率为50%,则此时的平 衡常数为100
衡常数为100
D.工业上采用稍高的压强(5 MPa)和250 ℃,是因为此条件下,原料气转化率最高
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)ΔH>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋
MgO(s)+CO2(g)+SO2(g)ΔH>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋 势合理的是
势合理的是

查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
下列有关化工生产的说法正确的是
A.将氯气通入澄清石灰水制取漂白粉
B.电解饱和食盐水溶液制取金属钠
C.SO2氧化为SO3时需要使用催化剂,这样可以提高SO2的转化率
D.用98.3%的浓H2SO4吸收 SO3,目的是防止形成酸雾,使SO3吸收完全
SO3,目的是防止形成酸雾,使SO3吸收完全
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
区别NaCl、FeCl3和NH4Cl三种溶液,可选用下列试剂中的( )
A.KSCN溶液  B.NaOH溶液 C.AgNO3溶液 D.BaCl2溶液
B.NaOH溶液 C.AgNO3溶液 D.BaCl2溶液
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
某固体粉末样品中可能含有SiO2、Fe2O3、CaO、CuO、MgO、Na2O和炭粉等成分,为确认其中的组分,某同学设计并完成了如下实验:
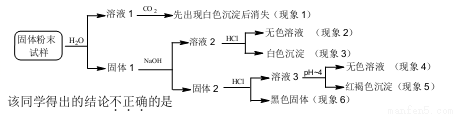
A.从现象1和3可推断样品中有CaO,没有Na2O
B.从现象3可推断样品中有SiO2
C.从现象4和5可推断样品中有Fe2O3和MgO
D.从现象4和6可推断样品中有炭粉,无CuO
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
已知1 mol CH4气体完全燃烧生成气态CO2和液态H2O,放出890.3 kJ热量,表示该反应的热化学方程式正确的是
A.CH4 (g)+2O2 (g)=CO2 (g)+2H2O(g) ΔH=+890.3 kJ·molˉ1
B.CH4 (g)+2O2 (g)=CO2 (g)+2H2O(l) ΔH=-890.3 kJ·molˉ1
C.CH4 (g)+2O2 (g)=CO2 (g)+2H2O(l) ΔH=+890.3 kJ·molˉ1
D.CH4 (g)+2O2 (g)=CO2 (g)+2H2O(g) ΔH=-890.3 kJ·molˉ1
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
下列化合物中,属于碱的是
A.MgO B.SO2 C.H2SO4 D.Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第五次调研化学卷(解析版) 题型:填空题
氮的化合物在生产生活中广泛存在。
(1)①可通过反应:NH3(g)+ Cl2(g)=NH2Cl(g)+ HCl(g)制备氯胺,己知部分化学键的键能:
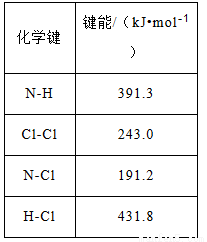
则上述反应的△H=______________。
② NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为:_________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t 的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t 的变化情况如下表所示:
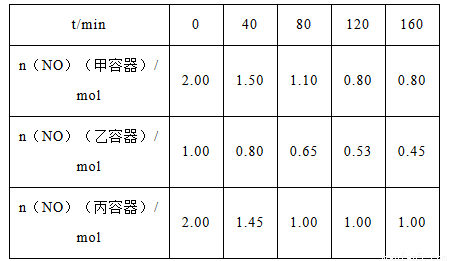
①该反应为________(填“放热”或“吸热”)反应
②乙容器在200min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
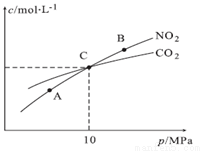
A、B两点的浓度平衡常数关系:Kc(A)________Kc(B)(填“< ”或“> ”或“=”)。
A、B、C三点中NO2的转化率最高的是:__________(填“A”或“B”或“C”)点.
计算C点时该反应的压强平衡常数:Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com