
 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K3=2.20×10-13 | - |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | - |
| NH3•H2O | NH3•H2O?OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s)?Ba2++SO42- | - | 1.1×10-10 |
| BaCO3 | BaCO3(s)?Ba2++CO32- | - | 1×10-9 |
分析 (1)溶液酸性强弱H3PO4>H2PO4->C6H5OH>HPO42-,C6H5OH与Na3PO4反应生成苯酚钠和HPO42-;
(2)25℃时,向10mL 0.01mol/LC6H5OH溶液中滴加V mL 0.1mol/L氨水恰好反应生成苯酚铵,电离平衡常数可知苯酚电离程度小,
a.pH>7,溶液显示碱性,则溶液中一定满足:c(OH-)>c(H+);
b.V=5时反应后得到等浓度苯酚溶液和苯酚铵溶液的混合溶液,物料守恒分析;
c.二者恰好反应生成苯酚铵,溶液显示碱性,则c(OH-)>c(H+)、c(NH4+)>c(C6H5O-);
d.若混合溶液PH<7,则苯酚一定过量,根据混合液中的物料守恒判断;
(3)水解平衡常数等于生成物浓度系数次幂之积与反应物浓度系数次幂之积的比;
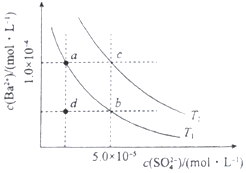
(4)①根据图片知,温度越高,硫酸钡的溶度积常数越大,根据T2时硫酸钡溶度积常数与 25°C时溶度积常数比较判断;
②a.硫酸钠抑制硫酸钡电离;
b.在T1曲线上方区域(不含曲线)为过饱和溶液;
c.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变;
d.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大;
③含有相同的离子能抑制硫酸钡的溶解,难溶物质向更难溶物质进行转化,硫酸根离子或钡离子浓度越大,硫酸钡的溶解度越小;
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为可以依据溶度积常数计算,c(CO32-):c(SO42-)=$\frac{Ksp(BaC{O}_{3})}{Ksp(BaS{O}_{4})}$.
解答 解:(1)电离平衡常数比较分析可知溶液酸性强弱H3PO4>H2PO4->C6H5OH>HPO42-,较强酸制备较弱酸的原理可知C6H5OH与Na3PO4反应生成苯酚钠和HPO42-,反应的离子方程式为:C6H5OH+PO43-=C6H5O-+HPO42-,
故答案为:C6H5OH+PO43-=C6H5O-+HPO42-;
(2)氨水的电离平衡常数大于苯酚的电离平衡常数,所以C6H5O-水解程度大于NH4+的水解程度,因此溶液显碱性,
a.溶液的pH>7时,溶质可能为苯酚铵或苯酚铵与氨水的混合液,V≥10,也可以是苯酚铵和苯酚混合溶液,V<10,则溶液中一定存在c(OH-)>c(H+),故a错误;
b.V=5时反应后得到等浓度苯酚溶液和苯酚铵溶液的混合溶液,苯酚过量,溶液中存在物料守恒,2c(NH3•H2O)+2c(NH4+)═c(C6H5OH)+c(C6H5O-),故b正确;
c.V=10时,二者恰好反应生成苯酚铵溶液,C6H5O-水解程度大于NH4+的水解程度,因此溶液显碱性,苯酚电离出的氢离子抑制水的电离,混合液中水的电离程度大于0.01mol/L C6H5OH溶液中水的电离程度,故c错误;
d.若混合溶液PH<7,则苯酚一定过量,溶液中离子浓度大小c(C6H5O-)>c(NH4+)>c(H+)>c(OH-)或c(C6H5O-)>c(H+)>>c(NH4+)>c(OH-),故d错误;
故答案为:b;
(3)Na2CO3第一步水解反应的水解离子方程式为:CO32-+H2O?HCO3-+OH-,Kh=$\frac{c(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(HC{{O}_{3}}^{-})c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{K{a}_{2}}$=$\frac{1{0}^{-14}}{5.61×1{0}^{-11}}$=1.78×10-4,
故答案为:1.78×10-4;
(4)①25°C时硫酸钡的Ksp=1.07×10-10,根据图片知,温度越高,硫酸钡的离子积常数越大,T2 时硫酸钡的溶度积常数=1.0×10-4×5.0×10-5=5×10-9>1.07×10-10,所以该温度大于25℃,故答案为:>;
②a.硫酸钠抑制硫酸钡电离,硫酸根离子浓度增大,导致溶液中钡离子浓度减小,所以可以使溶液由a点变为b点,故a错误;
b.在T1曲线上方区域(不含曲线)为过饱和溶液,所以有晶体析出,故b正确;
c.蒸发溶剂,增大溶液中溶质的浓度,温度不变,溶度积常数不变,所以蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b),故c正确;
d.升温增大溶质的溶解,溶液中钡离子、硫酸根离子浓度都增大,故d错误;
故选bc,
故答案为:bc;
③根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的浓度,所以硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:c>a>d>b,故选A,硫酸钡溶液中加入硫酸根离子和钡离子都会导致硫酸钡的沉淀溶解平衡逆移,硫酸钡的溶解度减小,硫酸根离子或钡离子浓度越大,硫酸钡的溶解度越小,所以BaSO4的溶解度的大小顺序:a>d>c>b,故选C,
故答案为:A;C;
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为可以依据溶度积常数计算,c(SO42-):c(CO32-)=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$×$\frac{c(B{a}^{2+})}{c(B{a}^{2+})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=1.1×10-10:1×10-9=0.11(或1.1×10-1),
故答案为:0.11(或1.1×10-1).
点评 本题考查较综合,涉及弱电解质电离、难溶物的溶解平衡、盐类水解等知识点,根据弱酸电离平衡常数及弱酸根离子水解程度的关系来分析解答,明确难溶物溶解平衡曲线变化趋势、纵横坐标的含义,知道不饱和转化为饱和溶液的方法,题目难度中等.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | c(OH-)=1×10-7mol/L | B. | c(H+)=1×10-7mol/L | ||
| C. | c(OH-)=c(H+) | D. | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 滴加石蕊呈红色的溶液可能大量存在K+、NH4+、Cl-、S2- | |
| C. | 与Al反应能放出H2的溶液中可能大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 漂白粉的水溶液可能大量存在Fe2+、Cl-、Ca2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4 | B. | CH3COOH | C. | (NH4)2 SO4 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl溶液、NaOH溶液、碱石灰 | B. | 浓氨水、NaOH固体、浓硫酸 | ||
| C. | NH4Cl固体、消石灰、碱石灰 | D. | 浓NaOH溶液、NH4C固体、浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
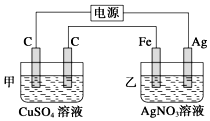 观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g.
观察如图所示装置,在通电一段时间后,铁电极的质量增加了5.4g.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com