
| 元素 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 578 | 1817 | 2745 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 元素Y是ⅢA族的元素 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
分析 X、Y是主族元素,I为电离能,X第一电离能和第二电离能差距较大,说明X为第IA族元素;
Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,X的第一电离能小于Y,说明X的金属活泼性大于Y,结合物质性质分析解答.
解答 解:X、Y是主族元素,I为电离能,X第一电离能和第二电离能差距较大,说明X为第IA族元素;
Y第三电离能和第四电离能差距较大,说明Y为第IIIA族元素,X的第一电离能小于Y,说明X的金属活泼性大于Y,
A.X为第IA族元素,元素最高化合价与其族序数相等,所以X常见化合价为+1价,故A正确;
B.通过以上分析知,Y为第IIIA族元素,故B正确;
C.元素X与氯形成化合物时,X的电负性小于Cl元素,所以在二者形成的化合物中X显+1价、Cl元素显-1价,则化学式可能是XCl,故C正确;
D.若元素Y处于第3周期,为Al元素,它不能与冷水剧烈反应,但能溶于酸和强碱溶液,故D错误;
故选D.
点评 本题考查元素电离能和原子结构关系,正确推断元素在周期表中的位置是解本题关系,灵活运用基本概念、基本理论结合物质结构、性质解答,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| C. | 0.1molCnH2n+2中含有的碳碳单键数为0.1nNA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源.
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源. 2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.
2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

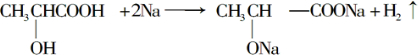 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
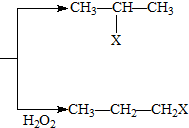 (X为卤素原子)
(X为卤素原子)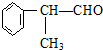 的物质,该物质是一种香料.
的物质,该物质是一种香料.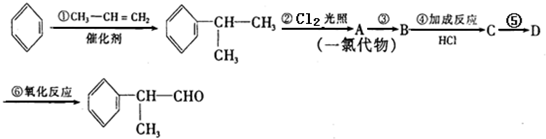
 .
.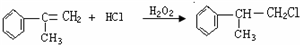 .
.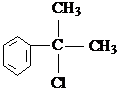 的水解产物
的水解产物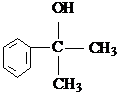 不能经氧化反应⑥而得到产品.
不能经氧化反应⑥而得到产品.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是取代反应,反应②③是氧化还原反应 | |
| B. | 水中溶解的NH3会导致水生动物死亡 | |
| C. | 向氨超标的河水中加稀硫酸是一种行之有效的处理方法 | |
| D. | 自来水中的HgCl2可加入Na2S处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 镁单质能和冷水发生剧烈的反应 | B. | 碱性Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性SiH4<HCl | D. | 金属性Na<Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com