

| 组分名称 | SiCl4 | SiHCl3 | SiH2Cl2 | HCl | BCl3 | PCl3 |
| 质量分数 | 0.545 | 0.405 | 0.0462 | 0.0003 | 0.00193 | 0.00157 |
| 沸点/℃ | 57.6 | 31.8 | 8.2 | -85 | 12.5 | 75.5 |
 .
.分析 根据流程反应I为焦炭和石英砂高温条件下发生反应生成Si和CO,反应Ⅱ主要为Si与氯气高温反应生成SiCl4,根据所得的四氯化硅粗品中所含的物质的沸点不同,经过精馏(或蒸馏)得到纯SiCl4,反应Ⅲ为SiCl4与氢气、氧气在1500℃时反应生成SiO2和HCl,反应IV为SiCl4与NH3在1400℃时反应生成Si3N4和HCl,据此分析解答.
解答 解:(1)根据以上分析,反应I为焦炭和石英砂高温条件下发生反应生成Si和CO,方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,Si化合价降低,则氧化剂为SiO2,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;SiO2;
(2)根据所得的四氯化硅粗品中所含的物质的沸点不同,经过蒸馏得到纯SiCl4,所以“操作X”的名称为精馏(或蒸馏),PCl3为共价化合物,则电子式为 ,故答案为:精馏(或蒸馏);
,故答案为:精馏(或蒸馏); ;
;
(3)反应Ⅲ为SiCl4与氢气、氧气在1500℃时反应生成SiO2和HCl,方程式为:SiCl4+O2+2H2$\frac{\underline{\;1500℃\;}}{\;}$SiO2+4HCl,反应IV为SiCl4与NH3在1400℃时反应生成Si3N4和HCl,方程式为:3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl,所以反应III和IV中尾气HCl的用途为制取盐酸,
故答案为:制取盐酸;3SiCl4+4NH3$\frac{\underline{\;1400℃\;}}{\;}$Si3N4+12HCl.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.


科目:高中化学 来源: 题型:选择题
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 气体的总物质的量 | |
| D. | 单位时间内生成nmolC的同时消耗2nmolB |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4g | |
| D. | 减压过滤的原理是抽气泵给吸滤瓶减压,造成吸滤瓶内与布氏漏斗液面上的压力差,从而加快过滤速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、MnO2 | B. | C、FeS | C. | Si、FeO | D. | CuO、Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
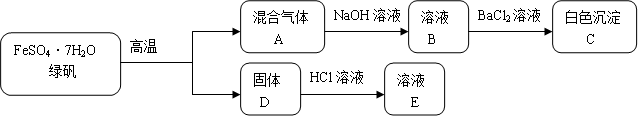
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.
1,3-丁二烯(CH2=CHCH=CH2)和2-丁炔(CH3C CH3)是重要的有机原料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com