
| A. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| B. | 可用25mL碱式滴定管量取20.00 mLKMnO4溶液 | |
| C. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 | |
| D. | 向乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液除去乙酸乙酯中的少量乙酸 |
分析 A.pH试纸不能湿润,否则可能为影响测定结果;
B.高锰酸钾溶液具有强氧化性,能够氧化碱式滴定管的橡胶管;
C.苯的密度小于水,应该从分液漏斗的上口倒出有机层;
D.碳酸钠溶液能够吸收乙醇、中和乙酸,且能够降低乙酸乙酯的溶解度.
解答 解:A.用pH试纸测定溶液的pH时,不能湿润试纸,否则若用蒸馏水润湿试纸,待测液被稀释,可能会影响测定结果,如测定出的酸溶液的pH偏高、碱溶液的pH偏低,故A错误;
B.高锰酸钾溶液能够氧化碱式滴定管的橡胶管,应该用酸式滴定管量取高锰酸钾溶液,故B错误;
C.用苯萃取溴水中的溴,由于苯的密度比水小,混合液分层后有机层在上层,分液时有机层应该从分液漏斗的上口倒出,故C错误;
D.碳酸钠能够中和乙酸、中和乙醇,故除去乙酸乙酯中的乙酸等杂质,可以用饱和碳酸钠溶液,故D正确;
故选D.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及pH试纸、滴定管、分液漏斗的使用方法、物质的分离与提纯等知识,明确常见仪器的构造及正确使用方法为解答关键,注意掌握pH试纸的使用方法,试题培养了学生的化学实验能力.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| B. | 无色透明的酸性溶液:MnO4-、K+、C1-、SO42- | |
| C. | 滴加KSCN显红色的溶液:NH4+、K+、Cl-、I- | |
| D. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应称取NaOH的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol奥沙拉嗪( ) 与足量Na2CO3溶液反应能生成4molC O2B ) 与足量Na2CO3溶液反应能生成4molC O2B | |
| B. | 已知反应mX(g)+nY(g)?qZ(g),若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为1:1 | |
| C. | 1L 1mol/LNa2CO3溶液中含有3×6.02×1023个离子 | |
| D. | 在一定温度下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol•L-1和是1.0×10-bmol•L-1,在此温度时,水的离子积为1.0×10-(b+a) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
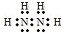 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com