
【题目】依据事实,书写下列热化学方程式:
(1)在25℃、101kPa时,1molC与1mol水蒸气反应生成1molCO和1molH2,吸热131.5kJ:______________________________________。
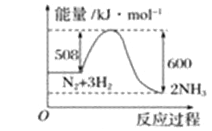
(2)根据下图写出热化学方程式__________________________________________。
(3)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应中和热的热化学方程式__________________。
(4)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1
2SO3(g) ΔH=-196.6 kJ·mol–1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1
2NO2(g) ΔH=-113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3和NO的热化学方程式____________________。
【答案】C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ/molN2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/molNO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJ/mol
【解析】
(1)在25℃、101kPa时,1molC与1mol水蒸气反应生成1molCO和1molH2,吸热131.5kJ,则反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) △H=+131.5kJ/mol。
(2)根据图像可知反应物总能量高于生成物总能量,反应热是508kJ/mol-600kJ/mol=-92kJ/mol,所以热化学方程式为N2(g)+3H2(g)=2NH3(g) △H=-92kJ/mol。
(3)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,由于中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以表示H2SO4与NaOH反应中和热的热化学方程式为1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ/mol。
(4)已知:
① 2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol–1
2SO3(g) ΔH=-196.6 kJ·mol–1
② 2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol–1
2NO2(g) ΔH=-113.0 kJ·mol–1
则根据盖斯定律可知(①-②)÷2即得到NO2与SO2反应生成SO3和NO的热化学方程式为NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJ/mol。


科目:高中化学 来源: 题型:
【题目】能源是人类生存和发展的重要支柱。研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义。已知H2与CO反应生成CH3OH的过程如图所示:
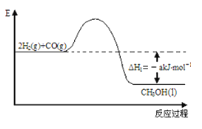
CO的燃烧热△H2=-b kJ/mol,CH3OH的燃烧热△H3=-c kJ/mol。请根据以上信息,回答下列有关问题:
(1)甲醇是一种______(填“可”或“不可”)再生能源,甲醇的官能团的电子式是____________。
(2)CH3OH燃烧热的热化学反应方程式为___________________________________。
(3)H2的燃烧热△H=_______________________。
(4)一些化学键键能如下:C≡O为d kJ/mol;O=O为ekJ/mol;C=O为fkJ/mol。则由以上数据算出b=_______(用d、e、f的代数式表示)。
(5)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。
CH3OH(g) ΔH=﹣d kJ/mol,在一定温度下,将1mol CO(g)和2molH2(g)充入到体积为10L的密闭容器中,发生反应。经过5min达到平衡,此时容器内压强为反应前的0.8倍。则此时v逆(CH3OH)为____________,正反应放出的热量为__________________,CO的转化率为___________。
(6)煤燃烧的烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为NO(g)+O3(g)=NO2(g)+O2(g) ΔH=-200.9kJ/mol,NO(g)+1/2O2(g)=NO2(g) ΔH=-58.2kJ/mol,SO2(g)+O3(g)=SO3(g)+O2(g) ΔH=-241.6kJ/mol,反应3NO(g)+O3(g)==3NO2(g)的ΔH=________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3A(g)+B(g)===2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为①v(A)=0.6 mol·L-1·min-1
②v(B)=0.45 mol·L-1·min-1
③v(C)=0.015 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·min-1,
则此反应在不同条件下进行最快的是( )
A. ②③B. ①③C. ②④D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是常用来衡量一个国家石油化工发展水平的标志性物质,A、B、C、D、E、F、G均为有机物,他们之间有如图转化关系,请回答下列问题:
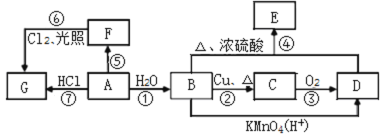
(1)写出A中官能团的名称:A________,B中官能团的电子式B________。
(2)在F的同系物中最简单的有机物的空间构型为________。
(3)写出与F互为同系物的含5个碳原子的所有同分异构体中一氯代物种类最少的物质的结构简式:___________________________________________。
(4)写出下列编号对应反应的化学方程式。
④ _____________________________;⑦ _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器中进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g) ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
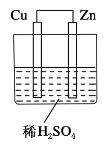
实验后的记录:
①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5 mol电子流经导线,则可产生0.25 mol气体
⑤电子的流向是:Cu―→Zn
⑥正极反应式:Cu+2e-===Cu2+,发生氧化反应
A. ①②③B. ②④C. ②③④D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g)![]() pC(g)+qD(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g)+qD(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且m+n______p+q(填“>”、“<”或“=”)。
(2)若加入催化剂,平衡时气体混合物的总物质的量________(填“增大”、“减小”或“不变”)。
(3)若B是有色物质,A、C、D均为无色物质,则加入C(体积不变)时混合物的颜色__________(填“变深”、“变浅”或“不变”),而维持容器内气体的压强不变,充入氖气时,平衡__________移动(填“向左”、“向右”、或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于可逆反应的是( )
A.Cl2与水的反应
B.氮气和氧气的反应
C.电解水生成H2和O2,点燃H2和O2的混合物生成H2O
D.甲烷和氯气光照发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
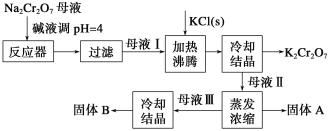
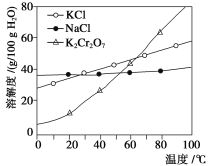
(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com