



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����������ӵĵ��Ӳ�ṹ�������⣩һ������һ����ϡ������ԭ����ͬ |
| B�����������ӵĵ��Ӳ���һ��������ԭ�ӵĵ��Ӳ����� |
| C�����������ӵİ뾶һ������ԭ�Ӱ뾶�� |
| D�����������������һ���ǰ˵��ӽṹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

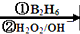 R-CH2CH2OH��
R-CH2CH2OH���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �Ȼ�ѧ����ʽ | �� �� | |
| A | 2H2��g��+O2��g��=2H2O��g����H=-483.6kJ/mol | ������ȼ����Ϊ241.8kJ/mol |
| B | NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l�� ��H=-57.3kJ/mol | ��40.0g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�������С��57.3kJ |
| C | 2C��s��+2O2��g��=2CO2��g����H=-a kJ/mol 2C��s��+O2��g��=2CO��g����H=-b kJ/mol | b��a |
| D | C��ʯī��s��=C�����ʯ��s����H=+1.5kJ/mol | ʯī�Ƚ��ʯ�ȶ� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��6.07 | B��2.62 |
| C��4.54 | D��3.43 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
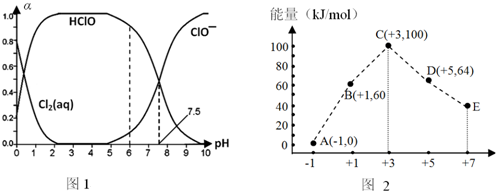
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
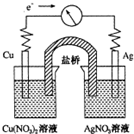 ����ӦCu��s��+2Ag+��aq���TCu2+��aq��+2Ag��s����Ƴ���ͼ��ʾ��ԭ��أ�����������ȷ���ǣ�������
����ӦCu��s��+2Ag+��aq���TCu2+��aq��+2Ag��s����Ƴ���ͼ��ʾ��ԭ��أ�����������ȷ���ǣ�������| A��KNO3�����е�K+����Cu��NO3��2��Һ |
| B��Ag��������Cu������ |
| C������һ��ʱ���Cu��NO3��2��Һ��c��Cu2+������ |
| D��ȡ�����ź����Ƶ�ָ����Ȼ����ƫת |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
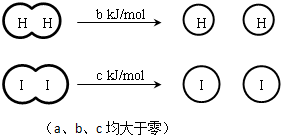
| A��H2��I2��HI�����еĻ�ѧ�����ǷǼ��Թ��ۼ� |
| B���Ͽ�2 mol HI�����еĻ�ѧ����������ԼΪ��c+b+a�� kJ |
| C����ͬ�����£�1 mol H2��g����1mol I2��g��������С��2 mol HI ��g���������� |
| D�����ܱ������м���2 mol H2��g����2 mol I2��g������ַ�Ӧ��ų�������Ϊ2a kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com