
【题目】下列实验现象描述错误的是
A. 硫在空气中燃烧,产生蓝紫色火焰
B. 将二氧化碳通入水中,无明显现象
C. 红亮的铜丝在酒精灯火焰上灼烧,铜丝表面变黑
D. 一氧化碳通过灼热的氧化铁,红色固体变黑
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图电解装置中,电极A是由金属M制成的,B、C和D都是铂电极,甲中的电解质溶液为MSO4 , 乙中的电解质为H2SO4 . E、F是外接直流电源的两极,电路接通后,电极B上有金属M析出.(已知金属M无变价) 
(1)电池中E是极,F是极.
(2)A极上电极反应为 , B极上电极反应为 , C极上电极反应为 , D极上电极反应为 .
(3)当电路中通过2.408×1022个电子时停止电解,发现B极上析出1.27gM,则金属M的相对原子质量为 .
(4)如果再将外接直流电源的正负极交换接入原电路,当通过1mol电子后,B极的电极反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学从古至今都与人类生活密切相关,下列说法正确的是( )
A.合成大量自然界不存在的新物质是现代化学的重要任务之一
B.现代的化工生产可以走“先污染,再治理”的发展路线
C.古人说的“以曾青涂铁,铁赤色如铜”属于物理变化
D.化学反应可以创造新的原子用于合成新的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1molL﹣1NaHCO3溶液的pH=8.31,有关该溶液的判断正确的是( )
A.c(Na+)>c(OH﹣)>c(HCO3﹣)>c(CO32﹣)>c(H+)
B.Ka1(H2CO3)Ka2(H2CO3)<KW
C.c(H+)+c(Na+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣)
D.加入适量NaOH溶液后:c(Na+)=c(H2CO3)+c(HCO3﹣)+c(CO32﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次增大,A的最高价和最低价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道是4s电子数的4倍.请回答下列问题:
(1)F的基态原了价电子排布式为;
(2)B、C、D、E的原子的第一电离能由小到大的顺序为;(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是;
A.分子中都含有σ键和π键
B.中心原子都sp杂化
C.都是含极性键和非极性键的非极性分子
D.互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+ , 其原因是BD分子中含有;
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为 , 该晶体的化学式为 , 若该晶体的相对分子质量为M,阿伏加德罗常数为NA , B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为 . 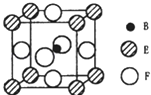
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素. 
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①结合上表数据,写出NO与活性炭反应的化学方程式;
②上述反应的平衡常数表达式K= , 根据上述信息判断,T1和T2的关系是;
A.T1>T2 B.T1<T2 C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是;
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2 , 具体流程如图1所示
①用离子方程式表示反应器中发生的反应;
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是;
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示通过a气体的电极是原电池的极(填“正”或“负”),b电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO47H2O的实验过程如下: 29.0g盐泥 ![]()
![]() 滤液Ⅰ→滤液Ⅱ→产品
滤液Ⅰ→滤液Ⅱ→产品
已知:①室温下Ksp[Mg(OH)2]=6.0×10﹣12 . ②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.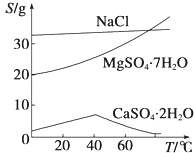
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是;
(2)若室温下的溶液中Mg2+的浓度为6.0molL﹣1 , 则溶液pH≥才可能产生Mg(OH)2沉淀.
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是 , 滤渣的主要成分是;
(4)从滤液Ⅱ中获得MgSO47H2O晶体的实验步骤依次为①向滤液Ⅱ中加入; ②过滤,得沉淀;③;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品.
(5)若获得的MgSO47H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为(MgSO47H2O的相对分子质量为246).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和NaHCO3性质的说法正确的是( )
A.在水中的溶解性:NaHCO3>Na2CO3
B.热稳定性:NaHCO3<Na2CO3
C.与酸反应的速率:NaHCO3<Na2CO3
D.只可能让NaHCO3转化成Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释合理的是( )
A.氢氟酸可用于雕刻玻璃,说明氢氟酸具有强酸性
B.常温下浓硝酸可用铝罐贮存,说明铝与浓硝酸不反应
C.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
D.铝箔在空气中受热熔化但不滴落,说明氧化铝的熔点比铝高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com