
 如图为实验室制备乙烯的装置图,请回答:
如图为实验室制备乙烯的装置图,请回答:分析 乙醇在浓硫酸做催化剂、脱水剂条件下加热到170度发生脱水反应生成乙烯,依据乙烯难溶于水,密度与空气密度相差不大选择收集方法,据此解答.
解答 解:Ⅰ、乙醇在浓硫酸做催化剂、脱水剂条件下加热到170度发生脱水反应生成乙烯,所以用到的试剂为:乙醇、浓硫酸;
故答案为:乙醇、浓硫酸;
Ⅱ、乙醇在浓硫酸做催化剂、脱水剂条件下加热到170度发生脱水反应生成乙烯,方程式:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
故答案为:C2H5OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;
Ⅲ、乙烯难溶于水,密度与空气密度相差不大,应选择排水法收集,故答案为:排水法.
点评 本题考查了乙烯的实验室制备,熟悉乙醇的结构与性质是解题关键,注意浓硫酸的作用,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:实验题
| 化学键 | N-H | N-N | N≡N | O-H |
| 键能(kJ.mol-1) | 390 | 190 | 946 | 460 |

| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/(mol/L) | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/(mol/L) | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
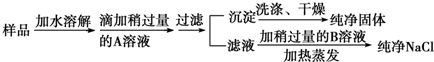
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ①④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
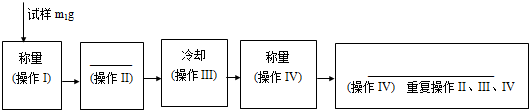
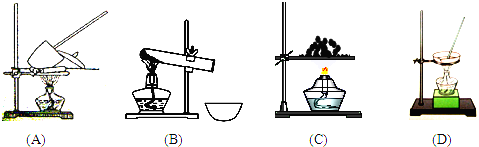
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com