
分析 反应中只有Cl元素化合价发生变化,KClO3中氯元素的化合价由+5价变为0价,HCl中Cl元素化合价由-1价升高到0价,所以根据得失电子守恒和原子守恒配平得方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,当有3mol Cl2生成时,转移5mol电子,以此解答该题.
解答 解:(1)反应中只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,所以根据得失电子守恒和原子守恒配平得方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,
,
故答案为:1;6;1;3;3; ;
;
(2)在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,KClO3中氯元素的化合价由+5价变为0价,所以KClO3是氧化剂,HCl中Cl元素化合价由-1价升高到0价,所以HCl是还原剂,故答案为:KClO3;HCl;
(3)在KClO3+6HCl═KCl+3Cl2↑+3H2O反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,生成0.5Cl2为还原产物,HCl中Cl元素化合价由-1价升高到0价,所以HCl是还原剂,生成2.5Cl2为氧化产物,则氧化产物和还原产物的物质的量之比是5:1;
又当有3mol Cl2生成时,转移5mol电子,所以当生成0.15molCl2时,转移的电子数目为0.25mol电子,
故答案为:5:1;0.25mol.
点评 本题考查氧化还原反应,为高频考点,根据反应中元素化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
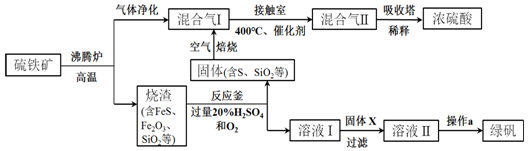
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2p1>p2 | B. | PCl5的分解率增大 | ||
| C. | p1>p2 | D. | Cl2的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化剂与还原剂的物质的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化剂与还原剂的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
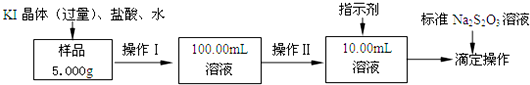
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| ① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| ② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| ③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| ④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| ⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| ⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| ⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| ⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| ⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| ⑩ | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com