
| A. | CO2在常温下是气体,SiO2在常温下是固体 | |
| B. | C、Si、Ge的最外层电子数都是4,次外层电子数都是8 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | 该族元素的主要化合价是+4和+2 |
科目:高中化学 来源: 题型:选择题
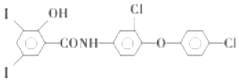
| A. | 与浓硫酸共热,有紫色气体产生 | B. | 分子中所有原子有可能在同一平面 | ||
| C. | 1mol只能与2molNaOH反应 | D. | 可使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
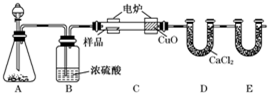
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 金属离子 | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
| 物质 | 20℃时溶解性(H2O) |
| CaSO4 | 微溶 |
| NiF | 可溶 |
| CaF | 难溶 |
| NiCO3 | Ksp=1.0×10-6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色 | 产生的气体为乙烯 |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀 | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀 | 淀粉已完全水解 |
| D | 在CuSO4溶液中加入KI溶液,再加入苯,振荡,有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
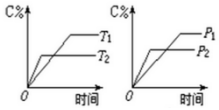 可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )
可逆反应m A(s)+n B(g)?e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图:下列叙述正确的是( )| A. | 达平衡后,若升温,则K减小 | |
| B. | 达平衡后,加入催化剂C%增大 | |
| C. | 化学方程式中n>e+f | |
| D. | 达平衡后,若增加A的量,B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
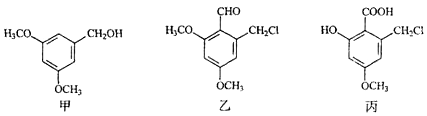
| A. | 甲、乙均能发生加成反应 | |
| B. | 甲的一种同分异构体中可能含有苯环和羧基 | |
| C. | 甲分子中的所有原子可能共平面 | |
| D. | 用酸性KMnO4溶液可鉴别乙和丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com