

 (1分) 2Al2O3(熔融)
(1分) 2Al2O3(熔融) 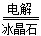 4Al+3O2↑(2分)。
4Al+3O2↑(2分)。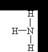 (1分),用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生(2分)
(1分),用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生(2分) T所处的周期序数与主族序数相等,所以T是Al,则P是Si,Q是C,R是N,W是S。
T所处的周期序数与主族序数相等,所以T是Al,则P是Si,Q是C,R是N,W是S。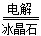 4Al+3O2↑。
4Al+3O2↑。 (2)同主族自上而下非金属性逐渐减弱,所以C的非金属性强于硅的;比较元素的非金属性,可以通过较强的酸制取较弱的酸来实现,即Na2SiO3 + CO2 + H2O = H2SiO3↓+ Na2CO3。
(2)同主族自上而下非金属性逐渐减弱,所以C的非金属性强于硅的;比较元素的非金属性,可以通过较强的酸制取较弱的酸来实现,即Na2SiO3 + CO2 + H2O = H2SiO3↓+ Na2CO3。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:实验题
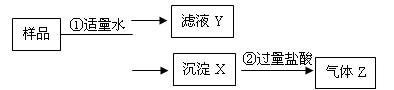
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
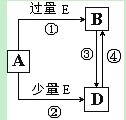
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
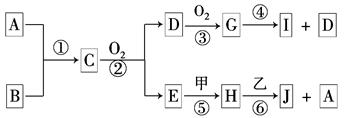
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
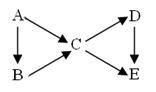
 ____。
____。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 后,得到气体的质量之比是____________________________。
后,得到气体的质量之比是____________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com