
��֪��A��B��C��D��E��F����Ԫ�غ˵�����������������ڱ���ǰ�����ڵ�Ԫ�ء�����Aԭ�Ӻ���������δ�ɶԵ��ӣ�������B2E�ľ���Ϊ���Ӿ��壬Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�D���ʵ��۵���ͬ����Ԫ���γɵĵ�������ߣ�F���γɺ�ɫ����ש��ɫ����F2O�ͺ�ɫ��FO���������
�ش��������⣺
��1��F��ԭ�ӵ�M������Ų�ʽΪ ��
��2��B��C��D�ĵ�һ��������С�����˳��Ϊ ������Ԫ�ط��ű�ʾ��
��3��A�ļ��⻯����Ӽ�������ˮ������Ҫԭ���� .
��4��E�������������ӵĿռ乹���� ��������ԭ�ӵ��ӻ���ʽΪ ��
��5��F�ĸ�������A�ļ��⻯���γɵ������ӣ���λ��Ϊ ��
��6��A��F�γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ�����仯ѧʽΪ ������ɫ���ʾFԭ�ӣ�����֪���ڵİ��������֮��ľ���Ϊa cm�� �þ������ܶ�Ϊ g/cm3��

 �����Ļ�������ҵϵ�д�
�����Ļ�������ҵϵ�д� ����������������ϵ�д�
����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
��10�֣����ֶ�����Ԫ��W��X��Y��Z��ԭ�����������������ϱ�����Ϣ�ش��������⡣
W | X | Y | Z | |
�ṹ ������ | ����������Ӧ��ˮ ����������̬�⻯�ﷴ Ӧ�õ����ӻ����� | ��ɫ��Ӧ�ʻ�ɫ | ��ͬ��������Ԫ���γɵļ������У����Ӱ뾶��С | ����������� ����֮��Ϊ6 |
��1��WԪ�غ�����γ����ӻ���������ʽΪ ��
��2��YԪ�غ�ZԪ�ؿ��γ�YZ3����������ھ�ˮ������ˮԭ�� (�����ӷ���ʽ��ʾ)��
��3�������п���Ϊ�Ƚ�X��Y������ǿ���������� ������ţ���
a������������ˮ����ļ��� b����Ӧ������ˮ��Һ��pH
c��������ˮ��Ӧ�����׳̶� d���������ᷴӦʱʧȥ�ĵ�����
����X��Y���⡢������Ԫ������ɵĻ��������������1:4��Ӧ�������ֳ����κ�ˮ����û�����Ļ�ѧʽΪ ��
��4��W��һ���⻯��HW3�������л��ϳɣ���������������ơ������Ũ�Ⱦ���ȵ�HW3��X������������Ӧ��ˮ�����ϣ���Ϻ���Һ������Ũ���ɴ�С��˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶������в��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���Cl2���ʵ�˵����ȷ����
A���ܶȱȿ���С B������ɫ��ζ������
C����ʹ�������ɫ������ɫ D������NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ�����и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ��ƶ���
A��G�����ʼ�Ĺ�ϵ��ͼ������B��DΪ��̬���ʡ�
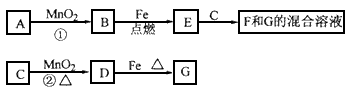
��ش��������⣺
��1������C��E�ֱ�Ϊ �� ���������ƣ�
��2����Ӧ�ٿ�ѡ�ò�ͬ��A���У�����Ӧ�ڳ����½��У��仯ѧ����ʽΪ ��
��3�������ʵ�����F��G�Ļ����Һ��F�Ľ��������ӡ���д���Լ��������������ۣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
��ÿ��2�֣���14�֣�Ϊ�˲ⶨ�������ƺ�̼���ƹ�������m g��̼���Ƶ������������ס�����λͬѧ�ֱ���������µ�ʵ�鷽����
��1����ͬѧ�ķ����ǣ�����Ʒ�ܽ⣬�������1mol��L��1�Ȼ�����Һ������ϴ�ӣ�ȡ������ɣ������ù���n g����������̼���Ƶ���������Ϊ____________����2�֣��ܷ��ù�����1mol��L��1�Ȼ�����Һ�����Ȼ�����Һ���ⶨ̼���Ƶ���������____ ___����ܡ�������2�֣�����_____ ����2�֣�
��2����ͬѧ�ķ����ǣ�����Ʒ�ܽ�����Թ������Ȼ�����Һ���ٵ���2��3�η�̪��Һ���ñ�����ζ�����ͬѧ�ڵζ�����������Ҫ����Ҫ����������___________����2�֣��ζ��յ�ʱ��������____________����2�֣���������Ȼ�����Һ��Ŀ����____________����2�֣��ж��Ȼ��������ķ�����_____����2�֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ������ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
(11��) �����������ʹ�õĽ���֮һ�����������仯������й�֪ʶ��ͬ���������⣺
��1���������Ͻ��������еij��ò��ϣ����������У���ȷ����________��(�����)
A������Ӳ�ȱ�������
B��������ʴ��ǿ����������
C������������Ͻ�ֻ������Ԫ��
D������һ�������£�����ˮ������Ӧ
E���������Ũ�����жۻ�
��2�����ˮ����εμ�1mol L-1FeCl3��Һ����Һ������ĺ��ɫ���÷�Ӧ�����ӷ���ʽΪ �����γɸ÷�ɢϵ�������ȷ�Χ�� ��
L-1FeCl3��Һ����Һ������ĺ��ɫ���÷�Ӧ�����ӷ���ʽΪ �����γɸ÷�ɢϵ�������ȷ�Χ�� ��
��3�����ӹ�ҵ����30����FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ������ӡˢ��·������д��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽ �����Ӹ�ʴ��ķ�Һ�л���ͭ�����»��FeCl3��Һ�����������Լ��������������ۢ�Ũ�����Ũ������ռ��Ũ��ˮ����Ҫ�õ���һ���Լ���_____________��
A���٢ڢ� B���٢ۢܢ� C���ڢܢ� D���٢ܢ�
��4����������(Na2FeO4)��һ�����;�ˮ����
�ٸ���������Ҫͨ�����·�Ӧ��ȡ��2Fe(OH)3+3X+4NaOH=2Na2FeO4+3NaCl+5H2O����X�Ļ�ѧʽΪ ��
�ڸ���������ˮ�п��Է������·�Ӧ��4FeO4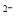 +10H2O==4Fe(OH)3+8OH
+10H2O==4Fe(OH)3+8OH +3O2�����ɴ˿��������������ܹ�ɱ����������Ϊ������___________�ԣ����ܹ���ȥˮ������������Ϊ ��
+3O2�����ɴ˿��������������ܹ�ɱ����������Ϊ������___________�ԣ����ܹ���ȥˮ������������Ϊ ��
������������������ˮ������___________��
a��KAl(SO4)2 l2H2O
l2H2O
b���ۺ�������
c��ClO2
d����84������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�갲��ʡ�߶���ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£���ӦN2��g����3H2��g��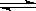 2NH3��g���ķ�Ӧ�Ⱥͻ�ѧƽ�ⳣ���ֱ�Ϊ��H��K�� ����ͬ�¶�ʱ��Ӧ4NH3��g��
2NH3��g���ķ�Ӧ�Ⱥͻ�ѧƽ�ⳣ���ֱ�Ϊ��H��K�� ����ͬ�¶�ʱ��Ӧ4NH3��g��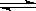 2N2��g����6H2��g���ķ�Ӧ�Ⱥͻ�ѧƽ�ⳣ��Ϊ
2N2��g����6H2��g���ķ�Ӧ�Ⱥͻ�ѧƽ�ⳣ��Ϊ
A��2��H��2K B��-2��H�� K2
C��2��H��-2K D��-2��H�� K-2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ�ൺ�и�����ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
ʵ��������500mL0.2mol•L��1��FeSO4��Һ�������������Ϊ��
������ƽ�ϳ�ȡһ���������̷���FeSO4•7H2O�������������ձ��У�������������ˮʹ����ȫ�ܽ⣻
�ڰ��Ƶõ���ҺС�ĵ�ע��500mL������ƿ�У�
�ۼ���������ƿ�еμ�����ˮ��Һ���̶���1��2cm��ʱ�����ý�ͷ�ι�С�ĵμӣ�ֱ����Һ�İ�Һ��ǡ����̶�������Ϊֹ��
������������ˮϴ���ձ��Ͳ�����2��3�Σ�ÿ�ε�ϴ��Һ��ת������ƿ�У�������ҡ�ȣ�
�ݽ�����ƿ���ã����ҡ�ȡ�
����д���пհף�
��1����������ƽ��ȡ���̷�������Ϊ�� ��
��2��������������ȷ˳��Ϊ�� ��
��3������ʵ������ж���õ������������ܽ�ʱ�������������ǣ� ������Һʱ�������������ǣ� ��
��4���۲�Һ��ʱ�������ӿ̶��ߣ���ʹ�����Ƶ���Һ��Ũ�� ���ƫ�ߡ�����ƫ�͡�����Ӱ�족��ͬ����������ˮʱ���������˿̶��ߺ�������Һ��ʹҺ����̶������У��� ��
��5���æ�=1.84g•mL��1����������Ϊ98%��Ũ��������200mL1mol•L��1��ϡ����������������Һ�IJ����ϵIJ����Ҫ�����㣺
�ټ��㣺������ӦȡŨ��������V= mL����ȷ��С�������λ����
����ȡ��������Ͳ��һ�ִ��Ե����ߣ����뾫ȷ��ȡ������ѡ�� �����������ƣ���
���ܡ�������
ϡ��Ũ����ķ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ��һ�����в��Ի�ѧ�Ծ��������棩 ���ͣ�ʵ����
(18��)��ͼΪ����ʵ��װ�á�
��1��д���������������ƣ�

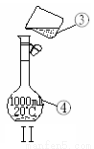
�� ���� ��
��2�������١����У�ʹ��ʱ�������Ƿ�©ˮ���� ��������ţ�
��3��������װ��I��ȡ����ˮ����ȱ�ٵ������� ���������������������ʵ�飬��ȴˮ�� �ڽ���
��4����������1.0 mol��L-1��NaOH��Һ240mL������װ��II��ijͬѧ���ƴ���Һʱת�Ʋ�����ʾ��ͼ��ͼ������������ֱ��� �� ��
��5��������Һʱ��һ����Է�Ϊ���¼������裺
�ٳ��� �ڼ��� ���ܽ� �ܵ�תҡ�� ��ת�� ��ϴ�� �߶��� ����ȴ
����ȷ�IJ���˳��Ϊ_____________________��
��6��ijͬѧ������һ������NaOH���壬������������ƽ�����ձ�����������ƽƽ����״̬��ͼ���ձ���ʵ������Ϊ_________g����ͬѧӦ����_________g NaOH��
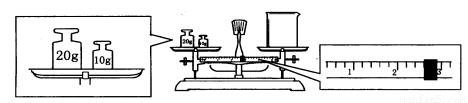
��7�������ƹ����У������������������ȷ�ģ����в���������Ũ��ƫ�ߵ���__________��
��û��ϴ���ձ��Ͳ�����
��ת����Һʱ������������Һ��������ƿ����
������ƿ�����������������ˮ
�ܶ���ʱ���ӿ̶���
�ݶ���ҡ�Ⱥ�����Һ������ڿ̶��ߣ��ٲ�����������ˮ���̶���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com