
����Ŀ���±��Ǽ������᳣���µĵ���ƽ�ⳣ����
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8��10-5 | K1=4.3��10-7 | K1=9.1��10-8 | K1=7.5��10-3 |
������˵���в���ȷ���ǣ�������
A.̼�������ǿ��������
B.��Ԫ�����������Ҫ�ɵ�һ���������
C.�����£���ˮϡ�ʹ��ᣬ ![]() ����
����
D.��������Һ�м�����NaOH��Һ�����볣������
���𰸡�C
��������A. ��Ϊ̼��K1�Ĵ����������K1������̼�������ǿ�������ᣬA���������⣻
B. ��Ԫ�����K1ԶԶ����K2��������������Ҫ�ɵ�һ�����������B���������⣻
C. �����£���ˮϡ�ʹ��ᣬ ![]() ��
�� ![]() ����Ϊ���볣����ˮ�����ӻ��ڳ����¶��Ƕ�ֵ��������ֵ���䣬C�������⣻
����Ϊ���볣����ˮ�����ӻ��ڳ����¶��Ƕ�ֵ��������ֵ���䣬C�������⣻
D. ���볣��ֻ���¶��йأ���������Һ�м�����NaOH��Һ�����볣�����䣬D���������⡣
�ʴ�Ϊ��C
���ݵ���ƽ�ⳣ���Ĵ�С�ж�������ǿ��˳��Ȼ������ı������Ե���ƽ���Ӱ�켴��.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾװ����,�۲쵽������ָ��ƫת,M�����,N����ϸ,����PΪ�������Һ���ɴ��ж�M��N��P�����������ʿ�����( )

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᱡ�������ML�������ӵ����ࡢ�����ǡ����ϵ��У��г�Ч������Ч������ṹ��ʽ����ͼ��ʾ������˵����ȷ����

A. ML�ķ���ʽΪ��C13H28O3 B. 1mol ML��ȫˮ��������2mol NaOH
C. ML������ȥ��Ӧ�IJ���ֻ��һ�ֽṹ D. ML�����е�����̼ԭ����ͬһƽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��Ŵ���һЩ�ܲ���ܼ����������뽫���ǰ������ɵ͵��ߵ�˳�����С�
��1��EK��EN��EL��EM��______________��
��2��E3s��E2s��E4s��E1s��____________��
��3��E4s��E4d��E4p��E4f��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.1 mol CO2 ������Ϊ44g/mol
B.H2SO4��Ħ������Ϊ98
C.��״���£�����Ħ�����ԼΪ22.4 L
D.O2����Է�������Ϊ32
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ���ǣ� ��
A.����������ʹNaCl����Һ������ʱ��Ӧ���ȱ߽���ֱ����Һ����
B.��10mL��Ͳ��ȡ8.58mL����ˮ
C.����ƿ����ʱ�۲�Һ��ʱ���ӣ���ʹ��õ���ҺŨ��ƫ��
D.�þƾ���ȡ��ˮ�е�I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йط�Ӧ����������ȷ����
A.��Ԫ�ػ��ϼ۷����仯�ķ�Ӧһ����������ԭ��Ӧ
B.�ֽⷴӦ�ķ�Ӧ��ֻ��һ��
C.���Ϸ�Ӧ��������ֻ��һ��
D.�е������ɵķ�Ӧһ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����顢�״����������Դ��
��1����֪�����Ȼ�ѧ����ʽ
��CO2(g)+3H2(g)=CH3OH��g�� +H2O (g)��H= -49.0 kJ/mol
��CH4(g)+2O2(g)=2H2O(g) +CO2(g) ��H= -802.3 kJ/mol
��2H2(g)+O2(g)=2H2O(l) ��H=-571.6 kJ/mol
��H2O(g)=H2O(l) ��H= -44.0 kJ-mol
��CH4(g)+1/2O2(g)=CH3OH(g) ��H =____________��
��2����ҵ�Ϻϳɼ״�����һ�ַ�����2H2(g)+CO(g) ![]() CH3OH(g) ��H��
CH3OH(g) ��H��
һ���¶�����3�������Ϊ1.0 L�ĺ����ܱ������з���������Ӧ��������������±���
���� | �¶�/K | ���ʵ���ʼŨ��/molL-1 | ���ʵ�ƽ��Ũ��/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
���÷�Ӧ����H______0(�>����<��)��
���ﵽƽ��ʱ������I��c(CH3OH)_____0.16mol/L(�>�� ��<�� ��=��)��
��400 K ʱ�÷�Ӧ��ƽ�ⳣ��K=________��
(3)���ױ���ij����������CO2��ȱ���Ƽ�����о���������:
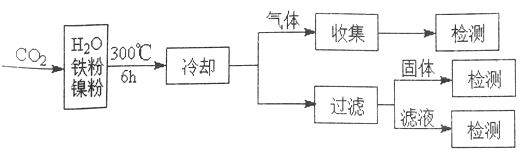
��Ӧ�����������м�CH4��H2����Һ�м�HCOOH�������м����ۺ�Fe3O4��CH4��HCOOH��H2 �IJ��������������Ĺ�ϵ����ͼ��ʾ(�Ǹı�����������������������)���о���Ա����ʵ�����ó�����:HCOOH ��CO2ת��ΪCH4 ���м��壬��:![]()
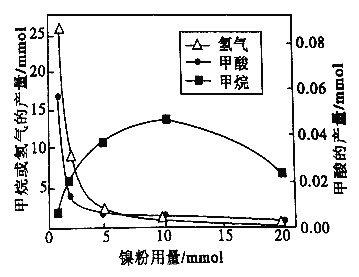
��д������H2�ķ�Ӧ����ʽ_________��
����ͼ��֪��������_______(����ĸ)��
a.��ӦI�Ĵ��� b.��ӦII �Ĵ���
c.��ӦI��II�Ĵ��� d.���Ǵ���
��������������1mmol���ӵ�10mmol����Ӧ���ʵı仯�����______(����ĸ)��
a.��Ӧ1���������ӣ���ӦII�����ʲ���
b.��ӦI�����ʲ��䣬��ӦII����������
c.��ӦI��II�����ʾ�����
d.��ӦI��II�����ʾ����ӣ��ҷ�ӦI���������ӵÿ�
e.��ӦI��II�����ʾ����ӣ��ҷ�ӦII ���������ӵÿ�
f.��ӦI�����ʼ�С����ӦII����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Է�ˮ�е�NH4+����һ�����������������ξ�ת��ΪNO3-������ͼʾ�ĵ绯ѧװ�ó�ȥNO3-�����й�˵����ȷ����
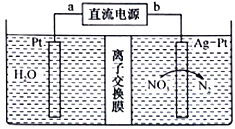
A. a����ֱ����Դ�ĸ���
B. ��װ�ðѻ�ѧ��ת��Ϊ����
C. ͼ�����ӽ���ĤӦΪ�����ӽ���Ĥ
D. �����ĵ缫��ӦʽΪ2NO3-+12H++10e-=N2��+6H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com