
【题目】有机物A由碳、氢、氧三种元素组成。现取3 g A与 4.48 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6 g,碱石灰增重4.4 g。回答下列问题:
(1)通过计算确定该有机物的分子式___________________。
(2)若有机物A能与金属钠反应放出氢气,请写出有机物A可能的结构简式___________。
【答案】 C3H8O ![]() 、
、![]()
【解析】根据已知生成二氧化碳、一氧化碳和水的质量确定分子中碳、氢、氧原子个数,进而确定分子式。再结合相关的性质确定官能团,进而确定物质的结构简式。
(1)浓硫酸增重3.6g为水的质量, n(H2O)=3.6g/18(g. mol-1) =0.2 mol根据H原子守恒可知n(H)=2n(H2O)=0.4 mol,碱石灰增重4.4g为二氧化碳的质量, n(CO2)=4.4g/44g.mol-1=0.1mol,4.48L氧气的物质的量=4.48L/22.4L. mol-1 =0.2 mol,氧气的质量=0.2mol×32g/mol=6.4g,故CO的质量=3g+6.4g3.6g4.4g=1.4g,故n(CO)=1.4g/28(g. mol-1 )=0.05 mol,根据C原子守恒可知n(C)= n(CO2)+ n(CO)=0.1mol+0.05mol=0.15mol。由O原子守恒可知3gA中n(O)=2n(CO2)+n(CO)+n(H2O)2n(O2)=2×0.1mol+0.05mol +0.2mol 2×0.2 mol= 0.05 mol,由上述分析知3gA中,n(H)=0.4mol,n(C)=0.15mol,所以,n(C):n(H):n(O)=3:8:1,故A的最简式为C3H8O,由H原子与碳原子数目可知,H原子已经饱和C原子四价结构,故其最简式即为分子式,A的分子式为C3H8O。答案:该有机物的分子式为C3H8O。
(2)有机物的分子式为C3H8O,为醇或醚,。因为有机物A能与金属钠反应放出氢气,所以只能为醇类,可能结构简式为CH3CH2CH2OH、![]() 。答案:有机物A可能的结构简式为CH3CH2CH2OH、
。答案:有机物A可能的结构简式为CH3CH2CH2OH、![]() 。
。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,可表明反应:A(g)+B(g)![]() C(g)+D(g) 已达化学平衡状态的是( )
C(g)+D(g) 已达化学平衡状态的是( )
A. 混合气体的压强 B. B的物质的量浓度 C. 混合气体的密度 D. v(A)正 = v(D)正
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烷、乙烯、乙炔组成的混合气体,完全燃烧后生成CO2和H2O的物质的量相同,原混合气体中三种烃的体积比不可能是( )
A. 1∶2∶1 B. 3∶2∶3 C. 2∶5∶2 D. 1∶2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫醉钠又名”大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图I所示.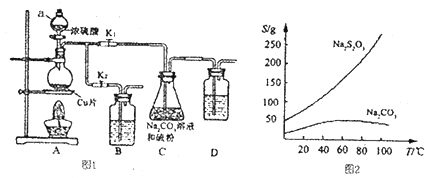
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.
(1)Na2S2O35H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装且气密性的操作是_ .
步骤2:加人药品,打开K1、关闭K2、加热.装置B、D中的药品可选用下列物质中的(填编号).
A.NaOH溶液 B.浓H2S04C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的最逐渐减少.
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 .
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加人足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时Cr42﹣全部转化为Cr2O72﹣;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010molL﹣1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O.I2+2S2O32﹣═S4O62﹣+2I﹣ , 则该废水中Ba2+的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是引起“温室效应”的主要物质,CO2的甲烷化可以实现其循环利用。
甲烷化过程中,可能发生如下反应:
I. CO2 (g)+4H2(g) ![]() CH4(g)+2H2O(g) △H1
CH4(g)+2H2O(g) △H1
II. CO2 (g)+4H2(g) ![]() CO(g)+2H2O(g) △H2
CO(g)+2H2O(g) △H2
已知反应II中相关的化学键键能数据如下:
化学键 | H—H | C=O | C | H—O |
E/(kJ·mol-1) | 436 | 750 | 1076 | 463 |
由此计算△H2=_________________。
(2)在常压、催化剂条件下,将CO2 和H2 (体积比为1:4,总物质的量为m mol)置于密闭容器中,发生反应I和II。测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)
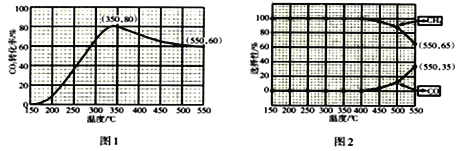
①由图1和图2可知,△H1___0(填“>”或“<”),____________可影响催化剂的选择性。
②由图1可知CO2的转化率呈现先升高后降低的变化趋势,其原因是________________________________。
③下列措施能提高CO2平衡转化率的是__________(填标号)
A.提高原料气中H2所占比例 B.适当增大压强 C.升高温度 D.增大催化剂的比表面积 E.前段加热,后段冷却
④350℃时,反应在t1时刻达到平衡,平衡时容器体积为VL,该温度下反应I的平衡常数为_____(用m、V表示)。
⑤550℃时,反应在t2时刻达到平衡,此时容器中H2O(g)的物质的量为__mol(用m表示)
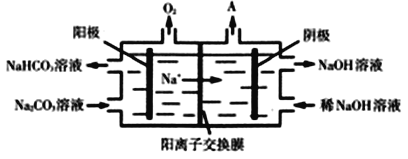
(3)CO2与NaOH溶液反应得到Na2CO3溶液。电解Na2CO3溶液的原理如图所示,阳极的电极反应式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
Ⅰ.1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
Ni=Co=59 | |||||
H=1 | Cu=63.4 | Ag=108 | Hg=200 | ||
Be=9.4 | Mg=24 | Zn=65.2 | Cd=112 | ||
B=11 | Al=27.4 | ?=68 | Ur=116 | Au=198? | |
C=12 | Si=28 | ?=70 | Sn=118 | ||
N=14 | P=31 | As=75 | Sb=122 | Bi=210? | |
O=16 | S=32 | Se=79.4 | Te=128? | ||
F=19 | Cl=35.5 | Br=80 | I=127 | ||
Li=7 | Na=23 | K=39 | Rb=85.4 | Cs=133 | Tl=204 |
Ca=40 | Pb=207 |
(1)门捷列夫将已有元素按照相对原子质量排序,同一_____(填“横行”或“纵列”)元素性质相似。
(2)结合表中信息,猜想第5列方框中“Te=128?”的问号表达的含义是___________。
Ⅱ.X、Y、Z、W是现在元素周期表中的短周期元素,它们的相对位置如下图所示,其中 Y 元素原子核外最外层电子数是其电子层数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中的位置____________________。
(2)比较Y、Z气态氢化物的稳定性______________(用分子式表示)。
(3)科学家们认为存在含氢量最高的化合物XH5,预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________,XH5是离子化合物,它的电子式为________。
(4)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是
A. 在上述条件下,SO2不可能100%地转化为SO3
B. 使用催化制是为了加快反应速率,提高生产效率
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 达到平衡时,SO2的浓度与SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质分别注入水中,振荡后静置,能分层浮于水面的是( )
①苯 ②乙酸乙酯 ③乙醇 ④乙酸 ⑤油脂 ⑥四氯化碳
A. ①②③ B. ①③⑤ C. ①②⑤ D. ①②⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com