
| A. | 氧化性:Na+>H+>Cu2+ | |
| B. | 还原性:Cl->S2->O2- | |
| C. | 等质量时的耗氧量:C2H6>CH4>C6H6 | |
| D. | 与金属钠反应的剧烈程度:C2H5OH<H2O |
分析 A.由金属活动性顺序表可知,金属性越强,对应离子的氧化性越弱;
B.非金属性越强,对应离子的还原性越弱;
C.等质量时,由最简式判断含H越多,消耗氧气越多;
D.水中O-H易断裂,乙醇中羟基H不活泼.
解答 解:A.由金属活动性顺序表可知,金属性越强,对应离子的氧化性越弱,则氧化性:Na+<H+<Cu2+,故A错误;
B.非金属性越强,对应离子的还原性越弱,则还原性:Cl-<S2-,还原性:S2->O2-,故B错误;
C.等质量时,由最简式判断含H越多,消耗氧气越多,则等质量时的耗氧量:CH4>C2H6>C6H6,故C错误;
D.水中O-H易断裂,乙醇中羟基H不活泼,则与金属钠反应的剧烈程度:C2H5OH<H2O,故D正确;
故选D.
点评 本题考查氧化还原反应及物质的性质,为高频考点,把握元素的位置、性质及氧化还原反应的应用等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | Cl2O | C. | Cl2O3 | D. | ClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH溶液和 KHSO4反应H++OH-=H2O | |
| B. | 铜和三氯化铁溶液反应Cu+Fe3+═Fe2++Cu2+ | |
| C. | 金属铝投入NaOH溶液中2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| D. | 氧化亚铁和稀硝酸反应FeO+2H+═Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有等物质的量的H+、Al3+的溶液中,逐滴加入NaOH 溶液:H+、A13+、Al(OH)3 | |
| B. | 在含有等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+ | |
| C. | 在含有等物质的量的MgCl2、NH4Cl的溶液中加入NaOH溶液:NH4Cl、MgCl2 | |
| D. | 在含有等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
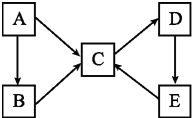 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com