
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
分析 无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;酸性溶液中含有大量氢离子,碱性溶液中含有大量氢氧根离子,分别根据酸性、碱性条件下讨论最多大量共存的离子数目即可.
解答 解:Fe3+为有色离子,在溶液中不能大量共存;
酸性溶液中,不与氢离子反应的离子有:H+、NH4+、Ba2+、Al3+、Cl-、NO3-,总共有6种;
碱性溶液中,不与氢氧根离子反应的离子为:Ba2+(或CO32-)、Cl-、OH-、NO3-,最多4种,
根据分析可知,最多含有6种离子,
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.


科目:高中化学 来源: 题型:选择题
| A. | NH4+、CO32-、K+、Na+ | B. | Na+、Ba2+、Cl-、HCO32- | ||
| C. | NO3-、Cu2+、K+、SO42- | D. | NO3-、K+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸加入大理石中:CO32-+2H+═H2O+CO2↑ | |
| B. | 氢氧化钡溶液中加入稀硫酸SO42-+Ba2+═BaSO4↓ | |
| C. | 硫酸溶液加入Cu(OH)2中:2H++Cu(OH)2═Cu2++2H2O | |
| D. | 稀盐酸加入铁粉中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3周期ⅥA族 | B. | 第3周期ⅥB族 | C. | 第3周期ⅣB族 | D. | 第3周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
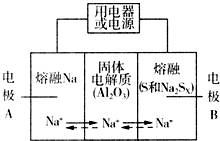 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com