
| A. | Y的低价氧化物能使Z单质的水溶液褪色 | |
| B. | X的氢化物溶于水显酸性 | |
| C. | 其离子半径大小:Z>Y>X | |
| D. | X的氢化物和Z的最高价氧化物对应的水化物不能反应生成盐 |
分析 短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为18,Y原子最外层电子数是X原子内层电子数的3倍,最外层电子数不超过8个,K层不超过2个,则X内层电子数是2,所以X位于第二周期,Y、Z位于第三周期,Y的最外层电子数为6,则Y为S元素,Z的原子序数大于S,所以Z为Cl元素,三种原子的最外层电子数之和为18,所以X的最外层电子数为5,则X为N元素,据此解答.
解答 解:短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为18,Y原子最外层电子数是X原子内层电子数的3倍,最外层电子数不超过8个,K层不超过2个,则X内层电子数是2,所以X位于第二周期,Y、Z位于第三周期,Y的最外层电子数为6,则Y为S元素,Z的原子序数大于S,所以Z为Cl元素,三种原子的最外层电子数之和为18,所以X的最外层电子数为5,则X为N元素,
A、Y为S元素,Y的低价氧化物二氧化硫能使氯气的水溶液褪色,即二氧化硫与氯气反应生成硫酸和盐酸,故A正确;
B、X的氢化物为氨气,氨气和水反应生成一水合氨,在水中电离生成按很离子合氢氧根离子,则溶液显碱性,故B错误;
C、电子层越多,半径越大,电子排布相同时,原子序数越大,离子半径越小,则离子半径大小:Y>Z>X,故C错误;
D、N的氢化物为氨气,Cl的最高价氧化物对应的水化物为高氯酸,二者反应生成高氯酸铵,属于盐,故D错误;
故选A.
点评 本题考查学生利用元素的位置及原子的最外层电子数和内层电子数的关系来推断元素,利用X为第二周期元素为突破口是解答本题的关键,学生应熟悉元素化合物知识来解答此类习题,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 4gNaOH固体所含电子总数为2NA | |
| B. | 22.4lL C2H6所含化学键总数为7 NA | |
| C. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA | |
| D. | 0.1 mol•L-1NH4Cl溶液中,NH${\;}_{4}^{+}$与Cl-数之和小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③⑤⑥ | C. | ①②③⑤⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金刚石转变为石墨是吸热反应 | |
| B. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2,则△H1>△H2 | |
| C. | 白磷比红磷稳定 | |
| D. | CO(g)+H2O(g)═CO2(g)+H2(g)△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2g氢气所含原子数目为NA | |
| B. | 1.7g NH3中含N-H键数目为0.1NA | |
| C. | 标准状况下,22.4L单质溴所含有的原子数目为2NA | |
| D. | 1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
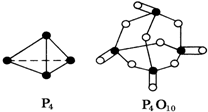 化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.
化学反应过程中发生物质变化的同时,常常伴有能量的变化,这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等.| 化学键 | P-P | P-O | O═O | P═O |
| 键能KJ/mol | 197 | 360 | 499 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用0.1mol Na2O2与足量水反应转移的电子的物质的量为0.2mol | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com