
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
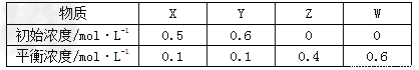
A. 反应达到平衡时,X的转化率为80%
B. 该反应的平衡常数表达式为K=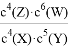
C. 增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D. 改变温度可以改变此反应的平衡常数
科目:高中化学 来源:2016-2017学年安徽省淮北市高一下学期第一次月考化学试卷(解析版) 题型:选择题
亚运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
A. 上述反应中Cl的化合价由+5价变为-1价
B. P2O5是P被还原后所得的产物
C. 该反应氧化剂与还原剂物质的量之比为5:6
D. 上述反应中消耗3mol P时,转移电子的物质的量为15mol
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:选择题
合成氨反应为:N2(g)+3H2(g) 2NH3(g
2NH3(g ).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是
).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.下列说法正确的是

A.由图1可知2NH3(g) N2(g)+3H2(g) △H=-92kJ·mol-1
N2(g)+3H2(g) △H=-92kJ·mol-1
B.图2中0~10min内该反应的平均速率v(H2)=0.09mol·L-1·min-1
C.图2中从11min起其它条件不变,压缩容器的体积,则n(N2)的变化曲线为d
D.图3中温度T1<T2,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三第五次模拟化学卷(解析版) 题型:选择题
下列各组离子或分子能大量共存,当加入相应试剂后,发生反应的离子方程式书写正确的是
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3·H2O |
B | Na+、OH-、Cl- | 少量Mg(HCO3)2溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
C | K+、NH3·H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+2H2O |
D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2+H2O |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:计算题
己知水在25℃和95℃时,其电离平衡曲线如图所示。

(1)则95℃时水的电离平衡曲线应为_____(填“A”或“B”),理由是_____。
(2)曲线A对应温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用a1、a2表示,则a1________ a2 (填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的PH ______7。
(3)在曲线B所对应的温度下,将0.02mol·L-1的Ba (OH)2溶液与等物质的量浓度的NaHSO4 溶液等体积混合,所得混合液的PH=_____。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A. H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B. 反应物的总能量低于生成物的总能量时,该反应为放热反应
C. 由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D. 已知:298K时,N2(g)+3H2(g)  2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:推断题
对乙酰氨基酚,俗称扑热息痛(Paracetamol),具有很强的解热镇痛作用,工业上通过下列方法合成(图中B1和B2、C1和C2分别互为同分异构体,无机产物略去):
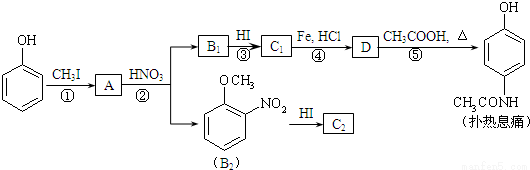
已知: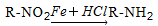 ,请按要求填空:
,请按要求填空:
⑴写出A分子中官能团名称:_________;C1的结构简式为:________________。
⑵写出由D生成扑热息痛的化学方程式:_______________________。
⑶写出反应③和④的反应类型:③______________,④__________。
⑷工业上设计反应①、②、③,而不是只通过反应②得到C1、C2,其目的是:______________________。
⑸扑热息痛有很多同分异构体,符合下列要求的同分异构体有5种:(I)是对位二取代苯;(II)苯环上两个取代基一个含氮不含碳、另一个含碳不含氮;(III)两个氧原子与同一原子相连。其中2种的结构简式是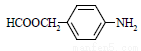 和
和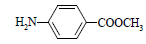 ,写出另3种同分异构体的结构简式____________、____________、____________。
,写出另3种同分异构体的结构简式____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:推断题
某盐 A是由三种元素组成的化合物,某研究小组按如图流程探究其组成:
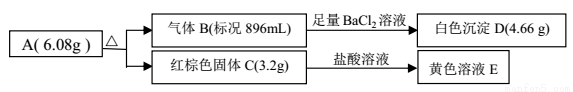
请回答:
(1)写出红棕色固体 C 的化学式____________。
(2)写出 A 受热分解反应的化学方程式____________。
(3)写出气体 B 与溶液 E 反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二下学期开学考试化学试卷(解析版) 题型:简答题
“霾”是当今世界环境热点话题。目前各地空气质量恶化原因之一是机动车尾气和燃煤产生的烟气。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
2NO(g)+2CO(g)  2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
2CO2(g)+N2(g) △H=-akJ·mol-1(a>0)
在一定温度下,将2.0 molNO、2.4 mol CO气体通入固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如图所示:
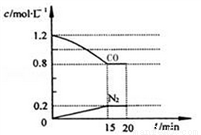
① 0〜15 min NO的转化率为_________。
②20 min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将________(选填“向左”,“向右”或“不”)移动,重新达到平衡后,该反应的化学平衡数为_______________。
(2)己知: 2NO(g)+O2(g) =2NO2(g) △H=-bkJ·mol-1(b>0) ; CO的燃烧热 △H=-ckJ·mol-1(c>0)
则在消除汽车尾气中NO2的污染时,NO2与CO发生反应的热化学反应方程式________ 。
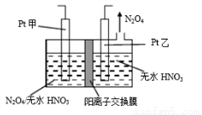
(3)工业废气中含有的NO2还可用电解法消除。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备N2O5,装置如图所示。Pt乙为_____极,电解池中生成N2O5的电极反应式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com