
【题目】举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼 (N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为_______,第一电离能最大的元素为_______。
(2)钛的原子序数为22,其基态电子排布式示意图为________________。
(3)1 mol N2H4分子中含有的键数目为_______。
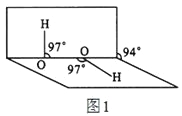
(4)H2O2分子结构如图1,其中心原子杂化轨道为_______,估计它难溶于CS2,简要说明原因___________。
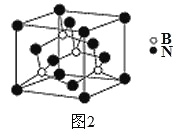
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为___,若立方氮化硼的密度为ρ g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。
【答案】第二周期ⅥA族 N 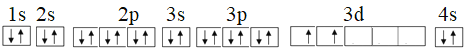 3.01×1024 sp3 H2O2为极性分子,CS2为非极性溶剂,所以H2O2不能溶解在CS2中 4
3.01×1024 sp3 H2O2为极性分子,CS2为非极性溶剂,所以H2O2不能溶解在CS2中 4 
【解析】
(1)N2H4、H2O2共有H、O、N三种元素,根据非金属性越强,其电负性越大,可知O元素为电负性最大的元素,O元素位于周期表中第二周第ⅥA族。由于N原子2p3上的电子处于半充满状态,很难失去1个电子,所以第一电离能最大。
(2)Ti的原子序数为22,Ti原子核外有22个电子,根据核外电子排布规律和相关规则,其基态电子排布示意图为 。
。
(3)N2H4中的N原子满足8电子结构,H原子满足2电子结构,N2H4的分子结构简式为H2N―NH2,可见1molN2H4中含有5mol键,其数目=5×6.02×1023个=3.01×1024个。
(4)H2O2中中心原子为O原子,O原子成2个σ键,有2对孤对电子,原子杂化轨道数=键数+孤对电子对数=2+2=4,故H2O2分子的中心原子采用sp3杂化。由H2O2的结构可知,H2O2为极性分子,而CS2为非极性溶剂,根据“相似相容原理”,H2O2不能溶解在CS2中。
(5)根据“均摊法”可知,1个氮化硼晶胞中含有N原子数=8×1/8+6×1/2=4,B原子全部位于晶胞内,共4个B原子,化学式为BN,由于B原子周围距其最近有4个N原子,其配位数是4,所以处于晶胞顶点上的N原子的配位数也为4;一个晶胞的质量为![]() g,设该立方氮化硼晶胞的边长为acm,则1个立方氮化硼晶胞的体积是a3 cm3,因此ρ=
g,设该立方氮化硼晶胞的边长为acm,则1个立方氮化硼晶胞的体积是a3 cm3,因此ρ=![]() ,解得a=
,解得a=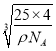 ,两个最近N原子间的距离是此晶胞面对角线的1/2,即为
,两个最近N原子间的距离是此晶胞面对角线的1/2,即为 。
。


科目:高中化学 来源: 题型:
【题目】固体表面化学对于化学工业很重要,有助于了解诸如钢铁为什么生锈、燃料电池如何工作、汽车尾气处理时催化剂的工作原理等。下列涉及该研究的项目中,说法正确的是
A.纯铁比生铁更易生锈
B.硝酸工业中,NH3和O2在铂系催化剂表面生成NO和H2O
C.氢氧燃料电池中,燃料在正极失去电子被氧化
D.臭氧层的破坏主要与CO2排放有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如图:
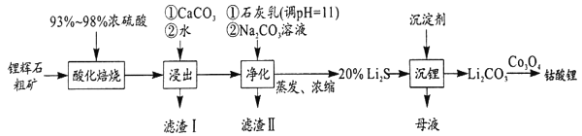
已知:Ksp[Mg(OH)2]=10-11,Ksp[Al(OH)3]=10-33,Ksp[Fe(OH)3]=10-38
回答下列问题:
(1)为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈__,可以认为该矿石中存在锂元素。
a.紫红色 b.紫色 c.黄色
(2)锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为__。
(3)为提高“酸化焙烧”效率,常采取的措施是__。
(4)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为__。(已知:完全沉淀后离子浓度低于1×l05)mol/L)
(5)“滤渣Ⅱ”的主要化学成分为___。
(6)“沉锂”过程中加入的沉淀剂为饱和的__溶液(填化学式);该过程所获得的“母液”中仍含有大量的Li+,可将其加入到“__”步骤中。
(7)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:
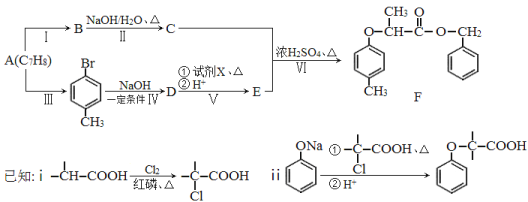
(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取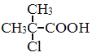 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一端弯成螺旋状的铜丝放在酒精灯火焰上加热,看到铜丝表面生成黑色的___(填化学式),再迅速把铜丝插入盛有乙醇的试管里,看到铜丝表面___,反复多次,试管内有___气味的___生成,其反应的化学方程式为___,反应中乙醇被___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为苯的硝化反应实验装置:
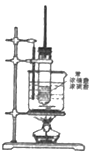
(1)写出该反应方程式__________________________,反应类型为_____________________。
(2)反应中采用的加热方式为________________,控制温度为_______________,试管上方长导管的作用是___________________________________。
(3)下列有关苯和硝基苯的叙述正确的是_______________。
a 密度都比水小 b 都不溶于水 c 互为同系物 d 都属于芳香烃
(4)有机反应主要分为取代、氧化、消去、加成、聚合五大类型。现有下列反应:
①由乙烯制氯乙烷 ②乙烷在空气中燃烧 ③乙烯使溴水褪色④乙烯通入酸性高锰酸钾溶液 ⑤由乙烯制聚乙烯 ⑥乙烷与氯气光照
其中属于取代反应的是___________________;属于氧化反应的是_____________________;
属于加成反应的是___________________;属于聚合反应的是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
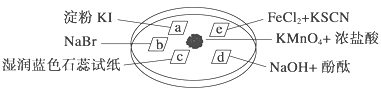
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3—环己二酮(![]() )常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。
)常用作医药中间体,用于有机合成。下列是一种合成1,3—环己二酮的路线。

回答下列问题:
(1)甲的分子式为 __________。
(2)丙中含有官能团的名称是__________。
(3)反应①的反应类型是________;反应②的反应类型是_______。
(4)反应④的化学方程式_______。
(5)符合下列条件的乙的同分异构体共有______种。
①能发生银镜反应
②能与NaHCO3溶液反应,且1mol乙与足量NaHCO3溶液反应时产生气体22.4L(标准状况)。
写出其中在核磁共振氢谱中峰面积之比为1∶6∶2∶1的一种同分异构体的结构简式:________。(任意一种)
(6)设计以![]() (丙酮)、乙醇、乙酸为原料制备
(丙酮)、乙醇、乙酸为原料制备![]() (2,4—戊二醇)的合成路线(无机试剂任选)_______。
(2,4—戊二醇)的合成路线(无机试剂任选)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知食盐常加入KIO3 来补充碘元素,检验食盐中是否加碘,可利用如下反应:__KIO3+___KI+___H2SO4═___K2SO4+___I2+___H2O(配平反应方程式)。
①利用上述反应检验食盐中是否加碘,所需试剂是________(填下列选项的序号)
A、碘水B、KI溶液C、淀粉溶液D、稀硫酸E、AgNO3溶液
②如果反应中转移0.2mol电子,则生成I2的物质的量为___________
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气)若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为___L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com