
【题目】(1)对于反应2SO2(g)+ O2(g) 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减少”、“不变”)。
编号 | 改变的条件 | 生成SO3的反应速率 |
① | 升高温度 | ___________ |
② | 降低温度 | ___________ |
③ | 增大氧气的浓度 | ___________ |
④ | 使用催化剂 | ___________ |
⑤ | 压缩体积 | ___________ |
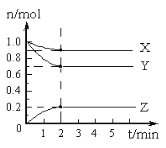
(2)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示。请回答下列问题。
①计算反应开始至2 min,Y的平均反应速率________。
②分析有关数据,写出X、Y、Z的反应方程式________。
③由图中看出:________分钟后,A、B、C各物质的物质的量不再随时间而变化,说明在这个条件下,该反应已达到了平衡状态。
【答案】增大 减少 增大 增大 增大 0.03mol·(L·min)-1 X(g)+3Y(g)2Z(g) 2
【解析】
(1)在可逆反应中,增大压强、升高温度,增大反应物的浓度以及使用催化剂都能增大反应速率,反之,反应速率减小,则:
①升高温度,则生成SO3的反应速率增大;
②降低温度,则生成SO3的反应速率减少;
③增大氧气的浓度,则生成SO3的反应速率增大;
④使用催化剂,则生成SO3的反应速率增大;
⑤压缩体积,压强增大,则生成SO3的反应速率增大;
(2)①反应开始至2 min,Y的平均反应速率为![]() =
= =0.03mol·(L·min)-1;
=0.03mol·(L·min)-1;
②由图知,相同时间内X、Y、Z的物质的量变化量分别为0.1mol、0.3mol、0.2mol,所以反应方程式为X(g)+3Y(g)![]() 2Z(g);
2Z(g);
③由图知,反应进行至2min时,A、B、C各物质的物质的量不再随时间而变化,此时反应达到平衡状态。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NH3和CH4的中心原子都是sp3杂化
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. SO2和CO2都是直线形分子,其中心原子都是sp杂化
D. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(![]() )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯中含氧官能团的名称是_________
(2)下列有关肉桂酸甲酯的叙述中,正确的是_________(填字母);
A.不能与溴的四氯化碳溶液发生加成反应
B.可以使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应
D.难以发生加聚反应
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。则G的结构简式为_________

(4)用芳香烃A为原料合成G的路线如下:
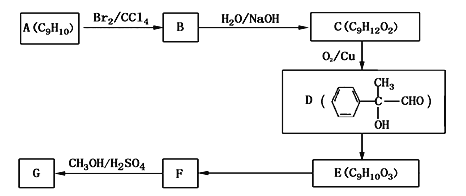
①A的结构简式________
②E→F的反应类型是_______
③C→D的化学方程式为__________________
④写出符合下列条件的F的同分异构体的结构简式__________
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图:
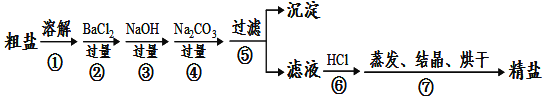
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是______。
(2)第②步操作的目的是除去粗盐中的______(填化学式,下同),第⑥步操作的目的是除去滤液中______。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、______(填化学式)。
(4)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是______。
(5)实验所得精盐的质量大于粗盐中NaCl的质量,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有1 mol HNO3和1 mol NaHSO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是( )
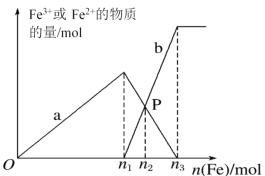
A.a表示Fe3+的关系曲线,b表示Fe2+的关系曲线
B.n1=0.5
C.P点时,n(Fe2+)=0.3mol
D.向P点溶液中加入铜粉,最多可溶解14.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铝的几种重要化合物之间的转化关系,下列表述不正确的是( )
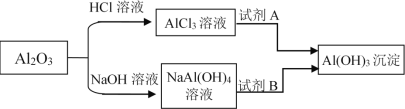
A.若加入的A是NaHCO3溶液,则生成沉淀的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑,溶液的pH增大
B.若加入的B是NaHCO3溶液,则生成沉淀的离子方程式为:Al(OH)4- + HCO3-=Al(OH)3↓+CO32-+H2O,溶液的pH减小
C.向AlCl3溶液中加入一定质量的Al(OH)3固体,一段时间后过滤,将所得固体洗涤干燥,称量,固体质量将增加
D.若加入的A是氨水、NaOH溶液或CH3COONa溶液等;或加入的B是NH4HCO3溶液、NH4Cl溶液或通入SO2、CO2气体等,均可析出Al(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含![]() 和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:
和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:![]() ,可实现氮氧化物无害转化。关于该反应下列说法不正确的是( )
,可实现氮氧化物无害转化。关于该反应下列说法不正确的是( )
A.升高温度能够加快反应速率
B.降低NO浓度能够减慢反应速率
C.使用合适的催化剂可以加快反应速率
D.加入足量的炭粉可以使![]() 转化
转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
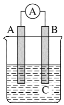
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Ag,B是Fe,C为稀AgNO3溶液
D.A是Fe,B是Ag,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com