
【题目】设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A.80 g硝酸铵中含有氮原子数为NA
B.0.1 molN5+离子中所含的电子数为3.4NA
C.1 mol甲烷和NA个甲烷分子的质量相等
D.16 g氧气和16 g臭氧所含的原子数均为NA
【答案】A
【解析】
A.根据n=![]() 可知80gNH4NO3的物质的量n=
可知80gNH4NO3的物质的量n=![]() =1mol,而1mol NH4NO3含2mol氮原子,故80g硝酸铵中含有氮原子数为2NA,故A错误;
=1mol,而1mol NH4NO3含2mol氮原子,故80g硝酸铵中含有氮原子数为2NA,故A错误;
B.N5+是N5失去一个电子从而形成的,故1molN5+含34mol电子,故0.lmolN5+离子中所含的电子数为3.4NA,故B正确;
C.1mol甲烷即NA个甲烷分子,故1mol甲烷和NA个甲烷分子的质量相等,故C正确;
D.16gO2的物质的量n=![]() =
=![]() =0.5mol,故含有的氧原子数N=0.5mol×2×NA=NA;16gO3的物质的量n=
=0.5mol,故含有的氧原子数N=0.5mol×2×NA=NA;16gO3的物质的量n=![]() =
=![]() =
=![]() mol,故含有的氧原子数N=
mol,故含有的氧原子数N=![]() mol×3NA=NA;故D正确;
mol×3NA=NA;故D正确;
故答案选A。


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】以黄铁矿烧渣(主要成分为Fe2O3及少量的FeS、SiO2、Cu、Au、Ag等)为原料制备颜料铁红(Fe2O3)、晶体E,回收H和重金属混合物的生产工艺流程如下图所示:

请按要求回答下列问题:
(1)工艺流程的中间产物(NH4)2Fe6(SO4)4(OH)12中Fe的化合价为__________________。
Fe在周期表中的位置为第________周期第Ⅷ族。
(2)将烧渣溶解前需进行“粉碎和提高温度”的目的是________________________。过程①溶解烧渣所需试剂中溶质的化学式为__________________。
反应②的化学方程式:______________________________________________________。
(3)反应③的目的是____________________________________。
气体Z的电子式:__________________。
写出反应④的离子方程式:______________________________________________________。
(4)将回收的G溶于少量水,所得溶液中所有离子的浓度由大到小依次是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳氧化合物、氮氧化合物、硫氧化合物等大气污染物的处理对缓解环境污染、能源危机具有重要意义。
(1)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法,反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)△H<0。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
4N2(g)+6H2O(g)△H<0。其他条件相同,在甲、乙两种催化剂作用下,相同时间时NO转化率与温度的关系如图。
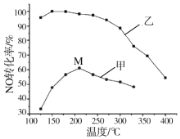
①工业上选择催化剂__________(填“甲”或“乙”)。
②在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率______(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时,NO转化率降低的原因可能是__________。(写一条即可)。
(2)某研究小组对反应NO2+SO2![]() SO3+NO△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。
SO3+NO△H<0进行相关实验探究。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n(NO2):n(SO2)]进行多组实验(每次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。部分实验结果如图所示。
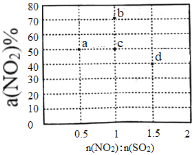
①如果将图中b点的平衡状态改变为c点的平衡状态,应采取的措施是________________。
②图中a、d两点对应的实验温度分别为T1和T2,则T1_______T2(填“>”、“=”或“<”)。
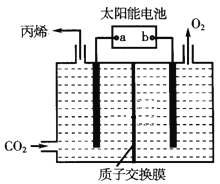
(3)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如图所示。
①太阳能电池的正极为_____(填“a”或“b”)。
②生成丙烯的电极反应式是_____________________________。
③当生成标准状况下2.24L丙烯时,右侧溶液中质量减少____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物分子中的碳碳双键发生臭氧氧化反应: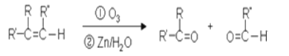 ,有机物A的结构简式为
,有机物A的结构简式为 ,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:
,G的分子式为C7H12O,以下A~H均为有机物,其转化关系如下:

(1)下列说法正确的是 ______ 。(填字母序号)
A.C的官能团为羧基
B.1molA最多可以和2molNaOH反应
C.C可以发生氧化反应、取代反应和加成反应
D.![]() 可以发生消去反应
可以发生消去反应
(2)F的结构简式为____________ ,由F到G的反应类型为___________ 。
(3)反应①的作用是__________________ ,合适的试剂a为____________。
(4)同时满足下列条件的A的一种同分异构体的结构简式______________________。
Ⅰ.与A具有相同的官能团;Ⅱ.属于苯的邻二取代物;Ⅲ.能使FeCl3溶液显色;Ⅳ.核磁共振氢谱分析,分子中有8种不同化学环境的氢原子。
(5)H与G分子具有相同的碳原子数目,且1molH能与足量的新制银氨溶液反应生成4mol单质银。写出H与足量的新制银氨溶液反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产的漂白粉,产品说明书如下:

请你回答:
(1)请你为漂白粉写一份保存、使用的注意事项(不超过30字)。____。
(2)用化学方程式表示:
①漂白粉的生产原理:_____________________________
②一般情况下,漂白粉失效的主要原因:____________;______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见四种有机物的比例模型示意图。下列说法正确的是
A. 能使酸性高锰酸钾溶液褪色
能使酸性高锰酸钾溶液褪色
B. 可与溴水发生取代反应使溴水褪色
可与溴水发生取代反应使溴水褪色
C. 中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键
中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键
D. 在稀硫酸作用下可与乙酸发生酯化反应
在稀硫酸作用下可与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g)△H <0,若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.2mol /L,0.6mol/ L,0.1 mol/L,则下列判断不合理的是
2Z(g)△H <0,若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达平衡时X、Y、Z的浓度分别为0.2mol /L,0.6mol/ L,0.1 mol/L,则下列判断不合理的是
A. 起始时c1:c2=1:3且 平衡时X、Y的转化率相等
B. c1的取值范围为0< c1<0.25mo /L
C. 反应开始后,Y和Z的生成速率之比为2:3
D. 对平衡体系加热,则混和气体的平均分子量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关分子结构如图所示,下列叙述中,正确的是 ( )
![]()
A. 除苯环外的其余碳原子有可能都在一条直线上
B. 所有的原子都在同一平面上
C. 12个碳原子不可能都在同一平面上
D. 12个碳原子有可能都在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com