
【题目】淀粉、葡萄糖及A、B、C、D、E之间的相互转化关系如图所示,已知气态烃B在标准状况下的密度为1.25gL-1,D具有酸性
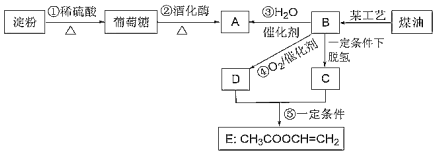
请回答:
(1)某工艺指的是______,A中的官能团名称是______
(2)已知C与D发生加成反应生成E,其化学方程式为______
(3)下列说法正确的是______
A.葡萄糖转化为A的反应类型为水解反应
B.可用溴的四氯化碳溶液鉴别B和C
C.E不溶于水,能使酸性高锰酸钾溶液褪色
D.A在热Cu丝催化氧化下可生成相对分子质量比它小2的有机物
【答案】裂解 羟基 ![]() CD
CD
【解析】
葡萄糖生成的A为CH3CH2OH,气态烃B在标准状况下的密度为1.25gL-1,则相对分子质量为1.25×22.4=28,可知B为CH2=CH2,氧化生成的D为CH3COOH,脱氢生成的C为CH≡CH,发生加成反应生成CH3COOCH=CH2,以此解答该题。
(1)煤油裂解可生成乙烯,A为乙醇,含有的官能团为羟基;
(2)C与D发生加成反应生成E,其化学方程式为CH≡CH+CH3COOH![]() CH3COOCH=CH2;
CH3COOCH=CH2;
(3)A.葡萄糖为单糖,不水解,转化为A的反应类型为氧化反应,故A错误;
B.B和C都含有不饱和键,都可与溴发生加成反应,则不能用溴的四氯化碳溶液鉴别,故B错误;
C.E属于酯类,不溶于水,含有碳碳双键,能使酸性高锰酸钾溶液褪色,故C正确;
D.乙醇在热Cu丝催化氧化下可生成乙醛,乙醛的相对分子质量比乙醇小2,故D正确;
故答案为:CD。


科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是________。
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______________(用离子方程式表示)。已知AlF![]() 在溶液中可稳定存在。
在溶液中可稳定存在。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为________,其中氧原子的杂化方式为________。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)===2ClF3(g) ΔH=-313 kJ·mol-1,F—F键的键能为159 kJ·mol-1,Cl—Cl键的键能为242 kJ·mol-1,则ClF3中Cl—F键的平均键能为________kJ·mol-1。ClF3的熔、沸点比BrF3的________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属的腐蚀除化学腐蚀和普通的电化学腐蚀外,还有“氧浓差腐蚀”,如在管道或缝隙等处的不同部位氧的浓度不同,在氧浓度低的部位是原电池的负极。下列说法正确的是
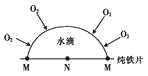
A. 纯铁的腐蚀属于电化学腐蚀
B. 钢铁发生吸氧腐蚀时,负极的电极反应式为Fe﹣3e﹣=Fe3﹢
C. 海轮在浸水部位镶一些铜锭可起到抗腐蚀作用
D. 在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e﹣=4OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于阴影部分的是( )
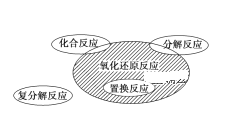
A.CO + CuO ![]() CO2 + Cu
CO2 + Cu
B.Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
C.Fe+H2SO4=FeSO4+H2↑
D.N2+3H2 ![]() 2NH3
2NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A能使溴水褪色,E能与NaHCO3反应,且标准状况下1molE与足量Na反应能产生11.2L气体。A的一系列反应如图(部分反应条件及产物略去):
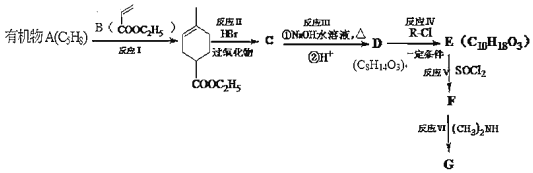
已知:(1)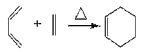
(2)![]()
![]()
![]()
(3)RCOOH![]() RCOCl
RCOCl ![]() RCON(CH3)2
RCON(CH3)2
回答下列问题:
(1)D的结构简式为______
(2)下列说法不正确的是______
A.有机物E中的官能团是羧基和酯基 B.有机物C的分子式为C10H17O2Br
C.反应Ⅲ、Ⅳ、Ⅴ、Ⅵ均属于取代反应 D.1mol有机物E最多可消耗2mol NaOH
(3)写出F→G反应的化学方程式______
(4)写出C5H9NO2满足下列条件的2种链状同分异构体的结构简式。
①红外光谱检测表明分子中含有醛基;②1H-NMR谱显示分子中有3种氢原子。______,______
(5)请设计以有机物A为原料合成(![]() )的合成路线______(用流程图表示,无机试剂任选)。
)的合成路线______(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用离子方程式(不能用离子方程式的用化学方程式)解释下列实验事实
⑴用纸层析法分离Fe3+、Cu2+时,氨熏显色后出现蓝色斑点_______________________________________________________________________ 。
⑵用新制的氢氧化铜检验牙膏中的甘油______________________________________________________________________ 。
⑶用AgNO3溶液、稀硝酸和NaNO2溶液直接检验火柴头中的氯元素_______________________________________________________________________ 。
⑷用水杨酸和乙酸酐在酸性条件下制备阿司匹林________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芴酮可用作工程塑料的改进剂。某芴酮可通过下列反应得到:
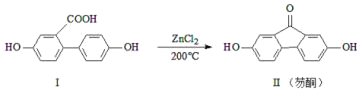
①化合物Ⅱ中含氧官能团为_____和_____(写名称)。
②鉴别化合物Ⅰ和化合物Ⅱ可用的试剂为_____(写化学式)。
③1mol化合物Ⅰ最多可与_____molNaOH完全反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com