
| m |
| M |
| n |
| v |
| m |
| M |
| 153×10-3g |
| 17g/mol |
| n |
| v |
| 9×10-3mol |
| 1L |
| 58g |
| 63.2g |
| ||
| △ |
| 4×5 |
| 4×0.20 |
| 4L |
| 4L+25L |
| 2.33g |
| 233g/mol |
| 19.53g |
| 217g/mol |


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
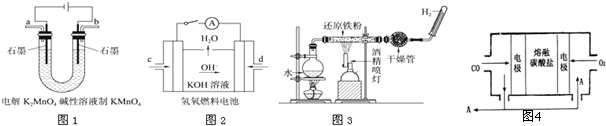
查看答案和解析>>
科目:高中化学 来源: 题型:
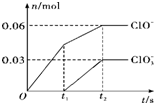 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( )| A、Cl2和苛性钾溶液在不同温度下可能发生不同反应 |
| B、反应中转移电子数为是0.21 NA |
| C、原苛性钾溶液中KOH的物质的量无法确定 |
| D、生成物中Cl-的物质的量为 0.21 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+ |
| B、Al3+ |
| C、Fe2+ |
| D、都没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该天然水具有暂时硬度和永久硬度 |
| B、加入适量的明矾,能除去此天然水的硬度 |
| C、将此天然水蒸馏,可得到蒸馏水 |
| D、将此天然水通过装有磺化煤的装置后可使之软化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
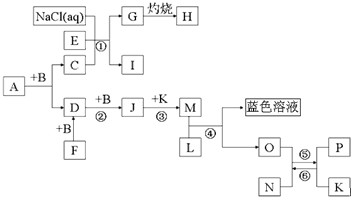
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合:C(Cl-)>C(NH4+)>C(OH-)>C(H+) |
| B、10mL0.1mol/LNH1Cl与5mL0.2mol/LNaOH两溶液混合:C(Na+)=C(Cl-)>C(OH-)>C(H+) |
| C、10mL0.1mol/L醋酸与5mL0.2mol/L NaOH混合:C(Na+)=C(CH3COO-)>C(OH-)>C(H+) |
| D、10mL0.5mol/LCH3COONa溶液与6mL0.1mol/L盐酸混合:C(Cl-)>C(Na+)>C(OH-)>C(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙炔是以乙炔为单体发生加聚反应形成的高聚物 |
B、聚乙炔的化学式为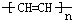 分子中所有碳原子不可能在同一直线上 分子中所有碳原子不可能在同一直线上 |
| C、聚乙炔是一种碳原子之间以单双键交替结合的链状结构的物质 |
| D、聚乙炔树脂不加任何填充物即可成为电的良导体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com