
| A�� | Fe3+ | B�� | Cr3+ | C�� | Zn2+ | D�� | Mg2+ |
���� ���c��OH-��=$\root{3}{\frac{Ksp}{c��F{e}^{3+}��}}$��c��OH-��=$\root{3}{\frac{Ksp}{c��C{r}^{3+}��}}$��c��OH-��=$\sqrt{\frac{Ksp}{c��Z{n}^{2+}��}}$��c��OH-��=$\sqrt{\frac{Ksp}{c��Mg{\;}^{2+}��}}$���㣬c��OH-��ԽС��������Ҫ��pHԽС���Դ������
��� �⣺25��ʱ��Ksp[Fe��OH��3]=4.0��10-38��Ksp[Cr��OH��3]=7.0��10-31��Ksp[Zn��OH��2]=1.0��10-17��Ksp[Mg��OH��2]=1.8��10-11��
c��OH-��=$\root{3}{\frac{Ksp}{c��F{e}^{3+}��}}$=$\root{3}{\frac{4.0��1{0}^{-38}}{0.01}}$��1.587��10-12��
c��OH-��=$\root{3}{\frac{Ksp}{c��C{r}^{3+}��}}$=$\root{3}{\frac{7.0��1{0}^{-31}}{0.01}}$��8.8��10-9��
c��OH-��=$\sqrt{\frac{Ksp}{c��Z{n}^{2+}��}}$=$\sqrt{\frac{1.0��1{0}^{-17}}{0.01}}$��3.2��10-7��
c��OH-��=$\sqrt{\frac{Ksp}{c��Mg{\;}^{2+}��}}$=$\sqrt{\frac{1.8��1{0}^{-11}}{0.01}}$��4.24��10-4��
c��OH-��ԽС��������Ҫ��pHԽС��
��ѡA��
���� ���⿼�����ܵ���ʵļ��㣬Ϊ��Ƶ���㣬��������Ũ����Ksp�Ĺ�ϵΪ���Ĺؼ������ط�������������Ŀ��飬ע��pH������������Ũ�ȹ�ϵ����Ŀ�ѶȲ���


 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
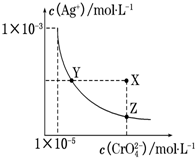 ��t��ʱ��Ag2CrO4���ٺ�ɫ����ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ�� ��֪AgCl��Ksp=1.8��10-10������˵����ȷ���ǣ�������
��t��ʱ��Ag2CrO4���ٺ�ɫ����ˮ��Һ�еij����ܽ�ƽ��������ͼ��ʾ�� ��֪AgCl��Ksp=1.8��10-10������˵����ȷ���ǣ�������| A�� | t��ʱ��Ag2CrO4��KspΪ1��10-8 | |
| B�� | �ڱ���Ag2CrO4��Һ�м���K2CrO4��ʹ��Һ��Y���ΪX�� | |
| C�� | t��ʱ��Y���Z��ʱAg2CrO4��Ksp��� | |
| D�� | t��ʱ����0.01 mol•L-1 AgNO3��Һ����20 mL 0.01 mol•L-1 KCl��0.01 mol•L-1 K2CrO4�Ļ����Һ�У�CrO42-�ȳ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
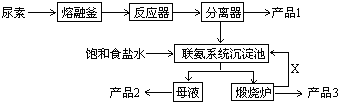
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
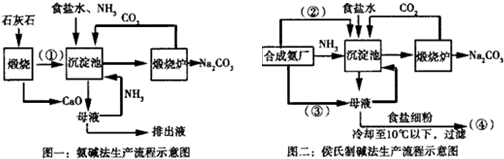
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
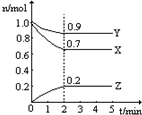 ij�¶�ʱ����һ��2L���ݵ��ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
ij�¶�ʱ����һ��2L���ݵ��ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�| ��� | �ı������ | ����Ӧ������ |
| �� | �����¶� | |
| �� | ����Y��Ũ�� | |
| �� | ʹ�ú��ʵĴ��� | |
| �� | ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������� | B�� | ���������� | ||
| C�� | ��Һ������ | D�� | �û���Ӧ��������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com