
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②NH4HSO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):③>①>② |
| D、pH=5的硫酸溶液稀释到原来的500倍,稀释后溶液中c(SO42-)与c(H+)之比约为1:10 |


科目:高中化学 来源: 题型:
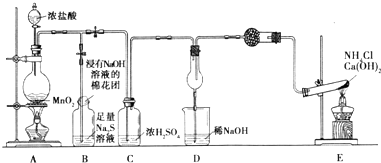
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳、硫元素在自然界中均存在多种同素异形体 |
| B、稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C、向饱和石灰水中加入少量CaO,振荡,恢复至室温后溶液的pH增大 |
| D、相同条件下,2 mol氢原子所具有的能量等于l mol氢分子所具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
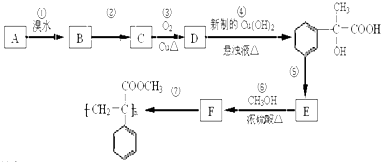
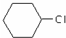 为原料合成重要的化工产品
为原料合成重要的化工产品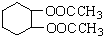 ,写出相应的合成路线流程图(无机试剂任用)
,写出相应的合成路线流程图(无机试剂任用)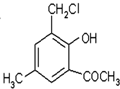 的同分异构体的结构简式:
的同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高纯硅是良好的半导体 |
| B、硅是制造太阳能电池的常用材料 |
| C、单质硅既不能与酸反应又不能与碱反应 |
| D、硅在地壳中含量居第二位,但在自然界中没有游离态的硅存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2ml | B、3ml |
| C、4ml | D、5ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Al3+、Cl-、CO32- |
| B、H+、Na+、Br-、SiO32- |
| C、Na+、Fe2+、SO42-、NO3- |
| D、K+、NH4+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com