
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | B. | 物质的量 C:CuO:Fe=3:2:2 | ||
| C. | 质量 MnO2:CuO:C=5.5:8:12 | D. | 质量 Fe:C:CuO=7:5:3 |
分析 6.4g红色沉淀为Cu,其物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,根据反应Fe+Cu2+=Fe2++Cu可知,生成0.1mol铜需要消耗0.1mol还原铁粉,而实际上消耗了0.15mol铁粉,则反应后的溶液中除了含有铜离子,还含有能够与铁反应的离子,结合选项可知应该为铁离子;根据反应Fe+2Fe3+=3Fe2+可知,0.05mol铁粉会消耗0.1mol铁离子,所以混合物中铜离子与铁离子的物质的量之比为1:1;该浓酸应该为浓硝酸,生成的气体为二氧化碳和二氧化氮气体,据此对各选项进行判断.
解答 解:6.4g红色沉淀为Cu,其物质的量为:$\frac{6.4g}{64g/mol}$=0.1mol,根据反应Fe+Cu2+=Fe2++Cu可知,生成0.1mol铜需要消耗0.1mol还原铁粉,而实际上消耗了0.15mol铁粉,则反应后的溶液中除了含有铜离子,还含有能够与铁反应的离子,结合选项可知应该为铁离子;根据反应Fe+2Fe3+=3Fe2+可知,0.05mol铁粉会消耗0.1mol铁离子,所以混合物中铜离子与铁离子的物质的量之比为1:1;
将上述生成的两种气体通入足量饱和NaHCO3溶液中,仍然收集到两种气体,该浓酸应该为浓硝酸,生成的气体为二氧化碳和二氧化氮气体,
根据分析可知,满足条件的只有B,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力,


科目:高中化学 来源: 题型:多选题
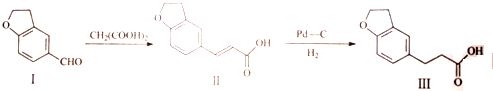
| A. | 可用浓溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| C. | 1mol化合物Ⅰ最多能与3molH2发生加成反应 | |
| D. | 与化合物Ⅰ互为同分异构体,且分子含有2个醛基的芳香族化合物有10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z<M | |
| C. | 简单离子半径由大到小的顺序是:Z>M>Y | |
| D. | 等浓度的X2Z与Y2Z的溶液中,水的电离程度:X2Z<Y2Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | R | |
| 主要化合价 | -4,+4 | -4,+4 | -2,+6 | -1,+7 |
| A. | 非金属性:Z<R<Y | |
| B. | T与R可以形成化合物:TR2 | |
| C. | X与R的单质均能使品红溶液褪色,且褪色原理相同 | |
| D. | T的最高价氧化物的水化物分别能与X、Y、Z的最高价氧化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知I2可溶于KI形成KI3,向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-?I2+I- | |
| B. | 物质的量浓度相等的H2CO3和Na2CO3溶液等体积混合后的溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积的浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 | |
| D. | 25℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量SO2:Na+、S2-、OH-、AlO2- | B. | 通入足量CO2:K+、Ca2+、Cl-、NO3- | ||
| C. | 通入足量Cl2:SO2、Ba2+、Cl-、K+ | D. | 通入足量NH3:Fe3+、Cl-、Ba2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①常用于分离沸点相差较大的液体混合物 | |
| B. | 图②用于吸收尾气SO2 | |
| C. | 图③用于干燥、收集少量NH3 | |
| D. | 采用图④的操作排出碱式滴定管尖嘴处的气泡 |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:实验题
冰晶石(Na3 AlF6)难溶于水,广泛应用于铝的冶炼。工业上用萤石(CaF2)为原料生产Na3 AIF6:
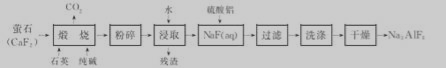
回答下列问题:
(1)Na3AIF6为助溶剂,冶炼铝的化学方程式为 。
(2)写出煅烧时总反应的化学方程式为________。
(3)煅烧后的固体在浸取前进行粉碎的目的是____,为达到相同目的,常温浸取时还可采取的措施是____。
(4)写出向NaF溶液中加入硫酸铝溶液发生反应的离子方程式:____。NaF溶液呈碱性,用离子方程式表示其原因: ,因此在按化学计量加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物 。
(5)97.5kg含CaF280%萤石(杂质不含氟元素)理论上可生产Na3 AIF6 kg(设生产过程中的每一步含氟物质均完全转化)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
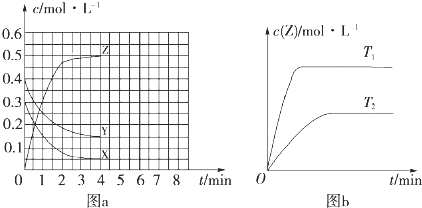
| A. | 发生反应时,各物质的反应速率大小关系为v(X)=v (Y)=2 v (Z) | |
| B. | 图a 中反应达到平衡时,Y 的转化率为37.5% | |
| C. | T0 时,该反应的平衡常数为 33.3 | |
| D. | 该反应正反应的反应热△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com