
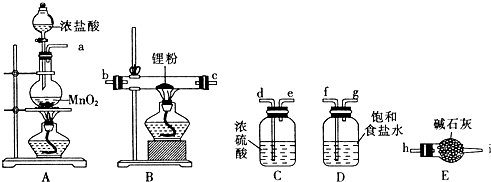
分析 根据题中提供的实验装置可知,用浓盐酸与二氧化锰发生氧化还原反应,生成氯气,所得氯气中有氯化氢和水杂质,所以制得的氯气先通过饱和食盐水,除去氯化氢,再通过浓硫酸干燥,得干燥纯净的氯气,与锂反应生成氯化锂,反应中未反应的氯气会污染空气,用碱石灰吸收尾气,同时能防止空气中的水蒸气进入使氯化锂潮解,据此答题.
解答 解:由题中提供的实验装置可知,用浓盐酸与二氧化锰发生氧化还原反应,生成氯气,所得氯气中有氯化氢和水杂质,所以制得的氯气先通过饱和食盐水,除去氯化氢,再通过浓硫酸干燥,得干燥纯净的氯气,与锂反应生成氯化锂,反应中未反应的氯气会污染空气,用碱石灰吸收尾气,同时能防止空气中的水蒸气进入使氯化锂潮解,
(1)根据上面的分析可知,A中发生反应的离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;
(2)根据上面的分析可知,上述装置按气流方向的连接顺序为:a→f,g→d,e→b,c或c,b→h,
故答案为:f、g;d、e;b、c或c、b;h;
(3)根据上面的分析可知,装置D的作用是吸收HCl,装置E的作用是防止空气中的水蒸气进入使氯化锂潮解和吸收多余的Cl2,防止污染空气,
故答案为:吸收HCl;吸收多余的Cl2,防止污染空气;
(4)若反应前金属锂的质量为3.80g,设未反应的锂为xg,根据方程式2Li+Cl2=2LiCl,有$\frac{14}{3.8-x}=\frac{42.5×2}{21.55-x}$,所以x=0.3,所以生成LiCl的质量为21.55g-0.3g=21.25g,所得产品中氯化锂的质量分数为$\frac{21.25}{21.55}$×100%=98.6%,
故答案为:98.6%.
点评 本题考查物质的含量测定,侧重于学生的分析能力、计算能力和实验能力的考查,题目难度不大,注意把握实验原理的分析和相关实验基本方法及注意事项.


科目:高中化学 来源: 题型:多选题
| A. | 所有原子不在同一平面 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 燃烧时有浓烟 | |
| D. | 与足量溴水反应时,生成物中只有2个碳原子上有溴原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消去反应,加成反应,取代反应 | B. | 取代反应,消去反应,加成反应 | ||
| C. | 消去反应,取代反应,加成反应 | D. | 取代反应,加成反应,消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁钉放入硫酸铜溶液中,溶液由蓝色变为浅绿色 | |
| B. | 将空气中燃着的硫伸入氧气瓶中,火焰由黄色变为蓝紫色 | |
| C. | 高温加热木炭与氧化铜的混合物,固体由黑色变成红色 | |
| D. | 往水中加入少量高锰酸钾,液体由无色变成紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |

 ,化学键有离子键、共价键
,化学键有离子键、共价键
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com