二甲醚(CH
3OCH
3)和甲醇(CH
3OH)被称为21世纪的新型燃料.以CH
4和 H
2O为原料制备二甲醚和甲醇的工业流程如图1.请填空:
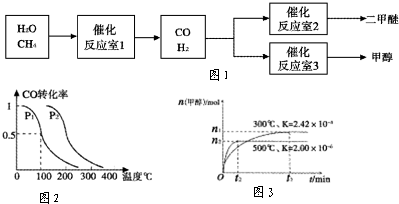
(1)在一定条件下,反应室1中发生反应:
CH
4(g)+H
2O(g)?CO(g)+3H
2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将
(填“增大”、“减小”或“不变”).将1.0mol CH
4和2.0mol H
2O通入反应室1(假设容积为10L),1min末有 0.1molCO生成,则1min内反应的平均速率v(H
2)=
mol/(L?min).
(2)已知:CO的燃烧热为283kJ/mol;
CH
3OCH
3(g)+3O
2(g)═2CO
2(g)+3H
2O(g)△H=-1323kJ/mol
2H
2(g)+O
2(g)═2H
2O(g)△H=-484kJ/mol
在一定条件下,反应室2的可逆反应除生成二甲醚外还生成了气态水,该热化学方程式为
.(本题涉及的条件均在同一条件下)
(3)反应室3中在催化剂作用下发生如下反应:CO(g)+2H
2(g)?CH
3OH(g).
对此反应进行如下研究:
①在压强为0.1MPa条件下,容积为2L时,充入0.2mol CO与0.4mol H
2在催化剂作用下反应生成甲醇.CO的平衡转化率与温度、压强的关系如图2所示.则p
1
p
2 (填“<”、“>”或“=”);在p
1压强下,100℃时,若温度不变,反应CO(g)+2H
2(g)?CH
3OH(g)的平衡常数K的值为
,再加入1.0 mol CO后重新达到平衡,则CO的转化率
(填“增大”、“不变”或“减小”),CH
3OH的体积分数
(填“增大”、“不变”或“减小”).
②在容积为1L的密闭容器中分别充入1mol CO和 2mol H
2,实验测得甲醇的物质的量和温度、时间的关系曲线如图3所示.则该正反应的△H
0(填“<”、“>”或“=”),判断的理由是
.
(4)我国某科研所提供一种碱性“直接二甲醚燃料电池”.该燃料电池负极的电极反应式为:CH
3OCH
3-12e
-+16OH
-═2CO
+11H
2O.
有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO
2的废气通入电解饱和食盐水所得溶液中,得NaHSO
3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO
3溶液中得SO
2气体回收.
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量.
.



 阅读快车系列答案
阅读快车系列答案