
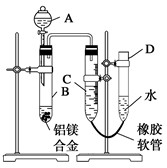
 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.分析 (1)整个操作过程及原理是:检查气密性;记录起始液面;加入碱反应;不产生气体后,记录C中的液面,两者相减即为产生H2的量;最后称得的固体即为Mg的质量.在读数时要注意D、C液面相平,否则气体将受压,造成读数不准;
(2)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而不和Mg反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量;
(3)B中发生的是Al与碱的反应;
(4)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,据w(Al)=$\frac{a-c\;\;\;g}{a\;\;g}$×100%的计算公式分析带来的误差;
(5)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量,而n(Al)可以由产生的H2获得.
解答 解:(1)实验时,记下量气管中C的液面位置,再加入NaOH溶液开始反应,待反应完毕并冷却至室温后,记录量气管中C的液面位置,最后将B中剩余固体过滤,洗涤,干燥,称重;量气管读数时为使里面气体压强与外界大气压相等,必须使D和C两管中液面相平,
故答案为:①④③②;使D和C的液面相平;
(2)根据铝镁的化学性质,铝镁都能与酸反应放出氢气,但铝还能与碱(如NaOH溶液)反应放出氢气,而镁不能,要测定铝镁合金中铝的质量分数,应选择NaOH溶液,
故答案为:NaOH溶液;
(3)观察实验装置图可知是用定量集气法完成实验目的,故A中应盛NaOH溶液,B管中发生铝与NaOH溶液的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,据w(Al)=$\frac{a-c\;\;\;g}{a\;\;g}$×100%的计算公式可知,未洗涤不溶物c增大,(a-c)的值减小,会造成铝的质量分数偏小,
故答案为:偏小;
(5)铝镁合金的质量为a g,B中剩余固体镁的质量为c g,则参加反应的铝的质量为(a-c)g,设铝的相对原子质量为M,则
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2M 3×22400ml
(a-c)g bml
解得:M=$\frac{33\;\;600\;\;\;a-c}{b}$,
故答案为:$\frac{33\;\;600\;\;\;a-c}{b}$.
点评 本题考查了探究实验、混合物的计算和测定,题目难度中等,注意把握镁铝的化学性质,侧重于元素化合物知识的综合应用的考查.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1gH2和8g O2 | |
| B. | 1molCO和22.4L水蒸气(一个标准大气压、100℃) | |
| C. | 18g水和标况时22.4L CO2 | |
| D. | 3molSO2和2mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol B和3 mol C | |
| B. | 2 mol A、1mol B和1 mol He(不参加反应) | |
| C. | 1 mol B和1 mol C | |
| D. | 2 mol A、3mol B和3 mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$\stackrel{浓硝酸}{→}$ Cu(NO3)2 | B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{硝酸银溶液}{→}$Cu(NO3)2 | D. | Cu $\stackrel{氧气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:
合成氨工业对国民经济和社会发展具有重要的意义.根据已学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N溶液无颜色 | |
| B. | M溶液里的两种阳离子为Na+和NH4+ | |
| C. | N溶液滴入BaCl2溶液无明显现象 | |
| D. | M溶液中通入足量CO2有白色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com