
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
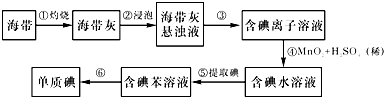
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径X>Y>Z | |
| B. | 气态氢化物稳定性X>Y>Z | |
| C. | 元素原子得电子能力由强到弱X>Y>Z | |
| D. | 单质与氢气反应由易到难X>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


 ,其中心原子的杂化类型是sp3杂化
,其中心原子的杂化类型是sp3杂化 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述两个反应都是氧化还原反应,且转移电子数相等 | |
| B. | Mn与Fe都属于ⅤⅡ族元素 | |
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-2(△H1+△H2) | |
| D. | 根据两个反应可以看出,非自发反应加入合适的催化剂可以自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1=2Q2<Q3 | |
| B. | 容器Ⅰ中CO的百分含量比容器Ⅲ中CO的百分含量高 | |
| C. | 容器Ⅰ中反应的平衡常数比容器Ⅱ中反应的平衡常数小 | |
| D. | 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域.
2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性化子可用作某些化学反应的催化剂,为合成对人类有用的重要化合物开辟了一个全新的研究领域. 、
、 .
. ②
② ③
③
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
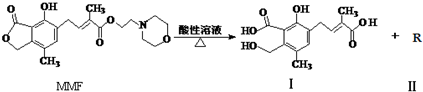
| A. | 1molMMF与足量NaOH 溶液共热,最多可消耗5molNaOH | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物 R的分子式为C6H13NO2 | |
| D. | 一个MMF分子中含有2个手性碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com