
【题目】在容积为2L的密闭容器中,某可逆反应在不同反应时间各物质的量的变化情况如图所示。
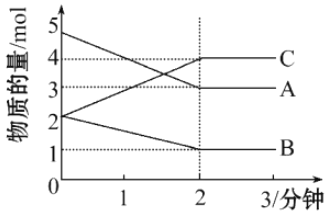
(1)则该反应的的反应物是______,生成物是_____;
(2)该反应的化学方程式为___________;
(3)从反应开始至2分钟时,用C表示其反应速率为________。
【答案】A、B C 2A+B2C 0.5mol/(L·min)
【解析】
从物质的物质的量的变化趋势判断反应物和生成物,根据物质的物质的量变化值等于化学计量数之比书写化学方程。
(1)由图象可以看出,A、B的物质的量逐渐减小,则A、B为反应物,C的物质的量逐渐增多,则C为生成物,故答案为:A、B,C。
(2)当反应开始至2min时,A的物质的量减少△n(A)=5mol-3mol=2mol,B的物质的量减少△n(B)=2mol-1mol=1mol,C的物质的量增加△n(C)=4mol-2mol=2mol,化学反应中,各物质的物质的量的变化值与化学计量数呈正比,则△n(A):△n(B):△n(C)=2:1:2,所以反应的化学方程式为:2A+B![]() 2C,故答案为2A+B
2C,故答案为2A+B![]() 2C。
2C。
(3)从反应开始至2分钟时,△n(C)=4mol-2mol=2mol,则用C表示其反应速率为v(C)=Δc/Δt=![]() =0.5mol/(L·min),故答案为:0.5mol/(L·min)。
=0.5mol/(L·min),故答案为:0.5mol/(L·min)。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列物质中既能跟稀盐酸反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al ③Al(OH)3 ④MgO
A.②③B.①②③C.②③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子核外电子排布规则,回答下列问题:
(1)写出基态S原子的核外电子排布式___________________________________,写出基态24Cr原子的价电子排布式________________________;
(2)写出基态N的原子核外电子排布图:__________________;
(3)若将基态14Si的电子排布式写成1s22s22p63s33p1,则它违背了_______________________;
(4)Fe3+比Fe2+的稳定性更________(填“强”或“弱”),从结构上分析原因是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分三层,工作时中间层熔融盐的组成及浓度不变。下列说法不正确的是( )

A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为Mg2++2e-=Mg
C. 该电池充电时,Mg-Sb(液)层发生还原反应
D. 该电池充电时,Cl-向中下层界面处移动
查看答案和解析>>
科目:高中化学 来源: 题型:
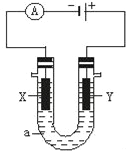
【题目】电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.(杂质发生的电极反应不必写出)请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①写出电解饱和NaCl溶液总的离子方程式_____.
②在X极附近观察到的现象是_____.检验Y电极反应产物的方法是_____.
(2)如要用电解方法精炼粗铜(含有锌铁镍银金和铂等微量杂质),电解液a选用CuSO4溶液,则:
①X电极发生的反应类型为_____;电子的流向由_____到_____(填X或Y).②Y电极的材料是_____,电极反应式为_____.CuSO4溶液的浓度_____(填“不变”“略有增加”或“略有减少”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石墨作电极电解下列溶液①稀H2SO4②K2SO4溶液 ③NaCl溶液 ④CuSO4溶液 ⑤KOH溶液
(1)阴极、阳极都有气体产生,且体积比(相同条件下)为2:1的是(填序号)__,
(2)阴极、阳极都有气体产生,且体积比(相同条件下)为1:1的是(填序号)__其阳极的电极反应式是__,电解的总方程式是__.
(3)阴极、阳极都有气体产生,其中溶液pH变小的是__,pH变大的是__.(填序号)
(4)一个电极析出金属,一个电极逸出气体,且溶液pH明显减小的是__(填序号),其总反应的化学方程式是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是
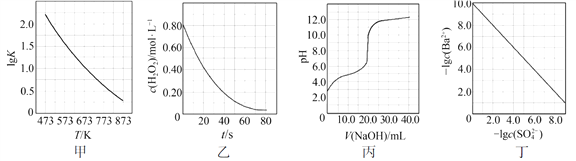
A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com