
| A. | 氢氧化亚铁被氧化:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| B. | 铝与稀硝酸反应:2Al+6H+═2Al3++3H2↑ | |
| C. | 过氧化钠和水反应:2Na2O2+2H2O═4Na++4OH-+H2↑ | |
| D. | 向硅酸钠溶液中通入过量二氧化碳:SiO32-+CO2+H2O═H2SiO3+CO32- |
分析 A.氢氧化亚铁容易被空气中氧气氧化成氢氧化铁;
B.铝与稀硝酸反应生成NO气体,不会生成氢气;
C.过氧化钠与水反应生成氢氧化钠和氧气,不是氢气;
D.二氧化碳过量,反应生成碳酸氢根离子.
解答 解:A.氢氧化亚铁被氧化的离子方程式为:4Fe(OH)2+2H2O+O2═4Fe(OH)3,故A正确;
B.铝与稀硝酸反应生成一氧化氮气体,正确的离子方程式为:NO3-+Al+4H+═H2O+NO↑+Al3+,故B错误;
C.过氧化钠和水反应生成氧气,正确的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,故C错误;
D.硅酸钠溶液中通入过量二氧化碳,反应生成硅酸胶体和碳酸氢根离子,正确的离子方程式为:SiO32-+2CO2+2H2O═H2SiO3(胶体)+2HCO3-,故D错误;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | BaCl2溶液 | D. | Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源间接制取的能源称为二级能源。比如氢气就是一种高效而没有污染的二级能源。据此判断,下列叙述正确的是( )
A.天然气是二级能源 B.石油是二级能源
C.焦炉煤气是一级能源 D.煤是一级能源
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
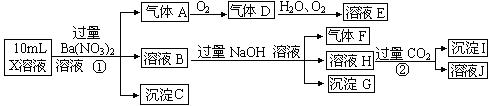
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过渡元素一定是金属元素 | |
| B. | 根据构造原理、泡利原理等核外电子排布规律可预测未来的第八周期包括的元素的种类有64个 | |
| C. | 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻 | |
| D. | 原子最外层电子数为2的元素一定是 IIA元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
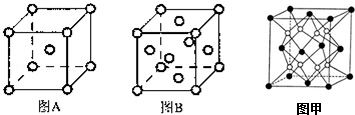
 其基态原子核外有26种不同电子运动状态;
其基态原子核外有26种不同电子运动状态;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com