
某同学实验报告中有以下数据,其中数据合理的是 ( )
A.用托盘天平称取11.7 g食盐
B.用量筒量取12.30 mL盐酸
C.用广泛pH试纸测得某溶液的pH值为3.6
D.用标准NaOH溶液滴定未知浓度的盐酸,用去21.20 mL NaOH溶液。
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡 | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3. 再向上述溶液中滴加淀粉溶液,振荡 再向上述溶液中滴加淀粉溶液,振荡 |
溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡. | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3.再向上述溶液中滴加淀粉溶液,振荡. | 溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
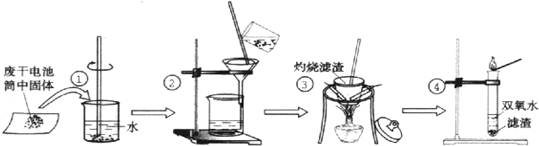
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少许滤液于试管中, |
含有Cl- | |
| 2.检验NH4+ | 取少许滤液于试管中, |
含有NH4+ | |
| 3.检验Zn2+ | 取少许滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加入氨水,沉淀又溶解 | 含有Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
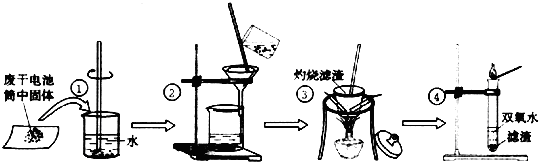
| 实验目的 | 操作 | 实验现象 | 结论 |
| 1.检验Cl- | 取少量滤液于试管中, |
含有Cl- | |
| 2.检验NH4+ | 取少量滤液于试管中, |
含有NH4+ | |
| 3.检验Zn2+ | 取少量滤液于试管中,加入稀氨水 | 先产生白色沉淀,继续加氨水,沉淀溶解 | 含有Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com