
| A. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I的核外电子数不同 | |
| B. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I的中子数分别为74和78 | |
| C. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I属不同种元素 | |
| D. | ${\;}_{53}^{127}$I和${\;}_{53}^{131}$I是同一种核素 |
分析 A.质子数=核外电子数;
B.中子数=质量数-质子数;
C.元素是具有相同的核电荷数(即核内质子数)的一类原子的总称;
D.具有一定数目质子和一定数目中子的一种原子叫做核素.
解答 解:A.53127I和53131I的质子数=核外电子数=53,故A错误;
B.中子数=质量数-质子数,53127I和53131I的中子数分别为74和78,故B正确;
C.53127I和53131I质子数相同,是同种元素,故C错误;
D.53127I和53131I质子数相同,而中子数不同,是不同种核素,故D错误.
故选B.
点评 本题考查核素、同位素等,侧重于常识性内容的考查,难度不大,注意基础知识的积累.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H14 | B. | C7H16 | C. | C8H18 | D. | C9H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
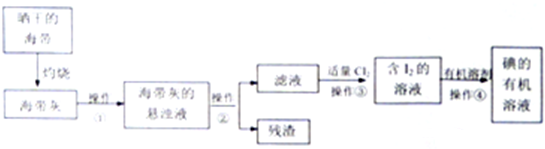
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| NaCO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
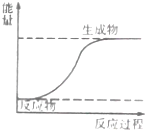
| A. | 如图表示化学反应过程中释放能量 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应中一定存在化学键的变化 | |
| D. | 原电池是将化学能转变成电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
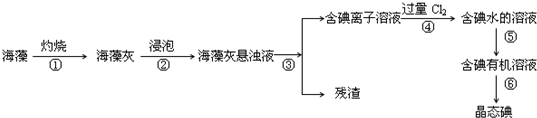
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2?2SO3 △H=-196.6kJ/mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═2H2O(l)△H=-285.8kJ/mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6kJ•mol-1 | |
| D. | C(s)+O2(g)═CO2(g)△H=+395.9kJ/mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com