
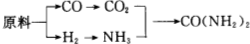

分析 (1)温度影响化学反应速率及化学平衡;工业生产中,以氨气为原料合成硝酸,是先将氨催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,据此写化学方程式;
(2)用原料所制得的H2和CO2的物质的量之比若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,原料的利用率最高,根据原料气产生的H2和CO2的物质的量之比判断;
(3)①根据反应物和生成物,写出反应Ⅰ的化学方程式;
②加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡;
(4)①二氧化硫和氢氧化钠反应生成NaHSO3;
②阳极区产生的气体氯气的溶液与二氧化硫发生氧化还原反应.
解答 解:(1)合成氨反应的化学方程式为:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$2NH3(g)△H=-92.2kJ/mol,在400~500℃的高温时,催化剂的催化活性最强,同时升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间;工业生产中,以氨气为原料合成硝酸,是先将氨催化氧化生成一氧化氮,一氧化氮与氧气反应生成二氧化氮,二氧化氮与水反应生成硝酸,所以工业生产硝酸的最后一步的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:催化活性最强,增加反应速率,缩短达到平衡的时间; 3NO2+H2O=2HNO3+NO;
(2)NH3(换算成H2的物质的量)和CO2的物质的量之比为2:1合成尿素,即H2和CO2的物质的量之比为$\frac{2×3}{2}$:1=3:1.
甲厂以焦炭和水为原料,CO+H2O$\frac{\underline{\;高温\;}}{\;}$CO2+H2,生成的H2和CO2的物质的量之比为2:1.
乙厂以天然气和水为原料,CH4+2H2O$\frac{\underline{\;高温\;}}{\;}$CO2+4H2,生成的H2和CO2的物质的量之比为4:1.
丙厂以石脑油和水为原料,C5H12+10H2O$\frac{\underline{\;高温\;}}{\;}$5CO2+16H2,生成的H2和CO2的物质的量之比为16:5,丙最接近3:1,
故答案为:丙;
(3)①根据反应物和生成物,写出反应Ⅰ的化学方程式为:2CaCO3+O2+2SO2=2CaSO4+2CO2,
故答案为;2CaCO3+O2+2SO2=2CaSO4+2CO2;
②亚硫酸根离子易被氧化,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是防止亚硫酸铵(NH4)2SO3被氧化,
故答案为:防止亚硫酸铵(NH4)2SO3被氧化;
③检验SO42-所用试剂是盐酸和氯化钡(HCl 和 BaCl2),
故答案为:盐酸和氯化钡(HCl 和 BaCl2);
(4)①二氧化硫和氢氧化钠反应生成NaHSO3,SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O),
故答案为:SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O);
②阳极区产生的气体氯气的溶液与二氧化硫发生氧化还原反应,SO2+Cl2+H2O=4H++SO42-+2Cl-,
故答案为:SO2+Cl2+H2O=4H++SO42-+2Cl-.
点评 本题考查了物质分离与提纯方法及其综合应用用,题目难度中等,涉及影响化学反应速率的因素、化学方程式的计算、离子反应等知识,考查的知识点较多、综合性较强,充分考查了学生的分析能力及化学实验能力.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题
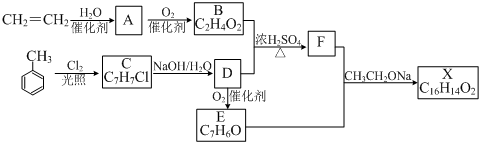
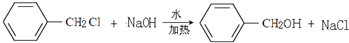 ,反应类型为水解反应或取代反应.
,反应类型为水解反应或取代反应.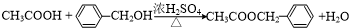 .
.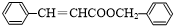 .
.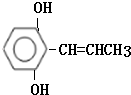 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液NaOH的 体积/mL | 标准盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 30.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
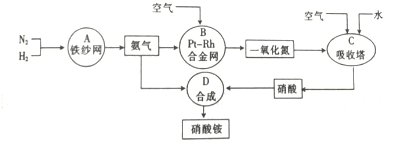
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2 的酯 | ||
| C. | 甲苯(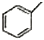 )的一氯代物 )的一氯代物 | D. | 立体烷(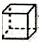 )的二氯代物 )的二氯代物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
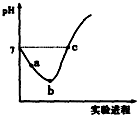 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-) | |
| C. | 由a点到b点的过程中,溶液中C(H+):C(ClO-)减小 | |
| D. | c点所示溶液中:c(Na+)=2c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )
,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m-1-a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
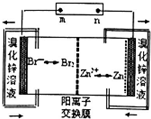
| A. | 充电时Zn2+通过阳离子交换膜由左侧流向右侧 | |
| B. | 放电时每转移2mol电子负极增重130g | |
| C. | 充电时阴极的电极反应式为Br2+2e-=2Br- | |
| D. | 若将电解液改为氯化锌溶液放电效果更好更安全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com