
推断溶液中所含有的离子,一般根据题目中描述的实验现象,依据常见离子的检验方法及离子共存的知识进行判断。这类题目综合了元素化合物的大部分知识,同时溶液的颜色、酸、碱性等也渗入其中。
例2、一杯澄清透明的溶液中,已知各离子的浓度均为0.1 mol·L-1 ,体积为1 L。可能含有的离子:阳离子为K+、Fe2+、Ba2+、NH4+,阴离子为Cl-、NO3-、CO32-、SO42-。向该混合液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变。对该溶液的下列叙述错误的是( )
A. 该溶液一定含有Fe2+、NO3-、Cl-
B. 该溶液一定不含K+、NH4+
C. 该溶液一定不含CO32-、Ba2+
D. 该溶液可能含有SO42-
科目:高中化学 来源: 题型:
下列各物质的分类、名称(或俗名)、化学式都正确的是
A.金属氧化物 氧化铁 FeO B.非金属氧化物 二氧化硫 SO2
C.碱性氧化物 过氧化钠 Na2O2 D.碱 纯碱 Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知I2+SO32-+H2O===SO42-+2I-+2H+。某无色溶液中只可能含有I-,NH4+,Ba2+, SO32-,MnO4-中的一种或几种,若向该溶液中滴加少量的溴水,溶液仍为无色,下列判断正确的是
A.该溶液中肯定不含I- B. 该溶液中可能含有Ba2+
C. 该溶液中肯定含有NH4+ D. 该溶液中可能含有MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
右下图所示装置可用于多种实验。
(1)实验室可利用该装置制取氯气,发生反应的化学方程式为:
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
 ①用双线桥标出上述反应中的电子转移情况。
①用双线桥标出上述反应中的电子转移情况。
②B装置的作用是___________________,C装置中盛装的液体最好是 。
③若按上述反应制得的氯气体积为4.48 L(标准状况),则实际反应中消耗12 mol/L盐酸的体积大于理论值_______mL。
(2)在实验室要测定部分变质的过氧化钠的纯度,也可用右图装置中的部分仪器。
①上述装置中多余的仪器是_______(填A、B、C、D等序号)。
②要完成上述实验目的,圆底烧瓶中发生反应的化学方程式为____________________。
③若取用样品的质量为2.5 g,收集到气体的体积为280 mL(标准状况),则样品中Na2O2的纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A.若无固体剩余,则溶液中一定有Fe3+
B.若有固体存在,则溶液中一定有Fe2+
C.若溶液中有Cu2+,则一定没有固体析出
D.若溶液中有Fe2+,则一定有Cu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
用过量的H2SO4、N aOH、NH3·H2O、NaCl等溶液,按下列步骤分开五种离子,则溶液①、②、③、④是
aOH、NH3·H2O、NaCl等溶液,按下列步骤分开五种离子,则溶液①、②、③、④是 ( )
( )
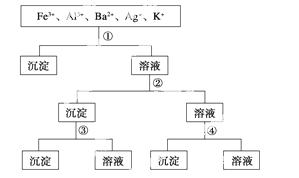
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①NaCl ②NH3·H2O ③NaOH ④H2SO4
C.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
D.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释实验现象的反应方程式正确的是( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl-
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO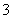 +Ca2++2OH-=CaCO3↓+CO
+Ca2++2OH-=CaCO3↓+CO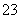 +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下面是用98%的浓H2SO4(ρ=1.84 g/cm3)配制成0.5 mol·L-1的稀H2SO4 500 mL的操作,请按要求填空:
①所需浓H2SO4的体积为________;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用________mL的量筒最好;
③将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100 m L水的烧杯里,并不断搅拌,目的是________________________;
L水的烧杯里,并不断搅拌,目的是________________________;
④将________的上述溶液沿________注入________中,并用50 mL蒸馏水洗涤烧杯2~3次,洗涤液要一并注入上述容器中,并摇匀;
⑤加水至距刻度线1~2 cm时,改用________加水,使溶液的凹液面正好跟刻度线相切。
(2)某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响?(填“ 偏高”、“偏低”或“不变”)
偏高”、“偏低”或“不变”)
①定容时观察液面俯视________;
②NaOH颗粒表面部分变质________;
③用胶头滴管向容量瓶中加水时凹面高于刻度线,此时立即用胶头滴管将瓶内液体吸出,使凹液面与刻度线相切________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com