CH
4是一种重要的化石燃料,在工农业生产中有着极其重要的应用.
(1)用甲烷可以消除氮氧化物的污染,其反应如下:CH
4(g)+2NO
2(g)?N
2(g)+CO
2(g)+2H
2O(g).在130℃和180℃时,分别将0.50mol CH
4和a mol NO
2充入1L的密闭容器中发生反应,测得有关数据如表:
| 实验编号 | 温度 | 时间/min
物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
(1)130℃时,达到平衡状态时CH
4的转化率为
.当温度为180℃、反应到40min时,该反应
(填“是”或“否”)达到平衡,推断的依据是
.
(2)由表中数据分析可知,该反应的△H
0(填“=”、“>”或“<”),130℃和180℃平衡常数的关系:K
(130℃)
K
(180℃)(填“=”、“>”或“<”).
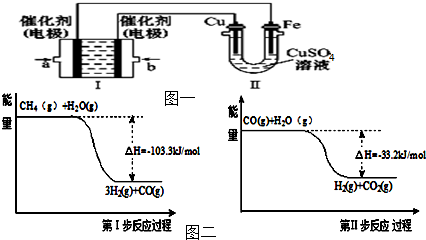
(3)如图一所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
①a电极上发生反应的电极反应式是
.
②电镀结束后,装置Ⅰ中溶液的pH
(填“增大”、“减小”或“不变”).
③若完全反应后,装置Ⅱ中Cu极质量减少12.8g,则装置Ⅰ中理论上消耗甲烷
L(标准状况下).
(4)用甲烷制取氢气的反应分为两步,其能量变化如图二所示:写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式
.




 阅读快车系列答案
阅读快车系列答案

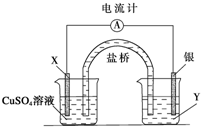 根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池:
根据下列氧化还原反应2FeCl3+Cu═2FeCl2+CuCl2设计一个原电池: