
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=![]() ,它所对应的化学反应为:__________________。
,它所对应的化学反应为:__________________。
(2)已知在一定温度下,
①C(s)+CO2(g)![]() 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g)![]() CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。
则K1、K2、K3之间的关系是________,ΔH3=__________________(用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)![]() H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是______反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________。
(4)高炉炼铁产生的废气中的![]() 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和![]() 反应制备甲醇:
反应制备甲醇: ![]() 。请回答下列问题;
。请回答下列问题;
①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 |
| 能量变化( |
甲 | 1 |
|
| 放出 |
乙 | 1 |
|
| 放出 |
丙 | 2 |
|
| 放出 |
则下列关系正确的是__________。
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
e.该反应若生成1![]()
![]() ,则放出(
,则放出(![]() 热量
热量
②若在一体积可变的密闭容器中充入1![]()
![]() 、2
、2![]()
![]() 和1
和1![]()
![]() ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________(填“正”或“逆”)反应方向移动。
【答案】 CO(g)+H2(g)![]() H2O(g)+C(s) K3=K1·K2 (a+b)kJ/mol 放热 75% ade 正
H2O(g)+C(s) K3=K1·K2 (a+b)kJ/mol 放热 75% ade 正
【解析】(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,在平衡常数中,分子为生成物,分母为反应物,结合质量恒定律分析书写;
(2)根据平衡常数的表达式推断;应用盖斯定律来求△H3;
(3)平衡常数随温度的变化来判断正反应方向是吸热还是放热,可以根据三行式结合平衡常数来求转化率;
(4)①a.甲、乙是完全等效平衡,平衡时各组分的浓度相等;b.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲;c.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,转化率增大,但2α1不一定等于α3 ;d.CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时甲醇的转化率为α2,乙中平衡时CO的物质的量为α2mol,甲与乙是完全等效平衡,平衡时对应各组分的含量完全相同;e.令平衡时CO的物质的量为nmol,CO(g)+2H2(g)CH3OH(g)的反应热△H=-QkJ/mol,则Q1=(1-n)Q、Q2=nQ,整理得Q=Q1+Q2。
②平衡时混合气体密度是同温同压下起始时的1.6倍,据此判断反应的方向。
(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数K=![]() 中,分子为生成物,分母为反应物,所以该反应的方程式为CO(g)+H2(g)C(s)+H2O(g),故答案为:CO(g)+H2(g)C(s)+H2O(g);
中,分子为生成物,分母为反应物,所以该反应的方程式为CO(g)+H2(g)C(s)+H2O(g),故答案为:CO(g)+H2(g)C(s)+H2O(g);
(2)根据化学方程式可知:K1=![]() ,K2=
,K2=![]() ,K3=
,K3=![]() ,所以:K3=K1×K2;由①+②可得方程式C(s)+H2O(g)CO(g)+H2(g),所以△H3=(a+b)kJ/mol,故答案为:K3=K1×K2;(a+b)kJ/mol;
,所以:K3=K1×K2;由①+②可得方程式C(s)+H2O(g)CO(g)+H2(g),所以△H3=(a+b)kJ/mol,故答案为:K3=K1×K2;(a+b)kJ/mol;
(3)由图可知温度越高K值越小,说明正反应为放热反应,
对于反应 CO(g) + H2O(g)H2(g)+CO2(g),
开始(mol/L):0.02 0.02 0 0
变化(mol/L): c c c c
平衡(mol/L):0.02-c 0.02-c c c
所以![]() =9,解得c=0.015,所以CO的转化率为
=9,解得c=0.015,所以CO的转化率为![]() ×100%=75%,故答案为:放热;75%;
×100%=75%,故答案为:放热;75%;
(4)①a.甲、乙是完全等效平衡,平衡时各组分的浓度相等,所以平衡时甲醇的浓度c1=c2,故a正确;b.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲,丙中参加反应的CO大于甲中的2倍,故2Q1<Q3,故b错误;c.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲,但2α1不一定等于α3 ,故c错误;d.甲与乙是完全等效平衡,平衡时对应各组分的含量完全相同,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时甲醇的转化率为α2,乙中平衡时CO的物质的量为α2mol,故(1-α1)=α2,整理得α1+α2=1,故d正确;e.令平衡时CO的物质的量为nmol,CO(g)+2H2(g)CH3OH(g)的反应热△H=-QkJ/mol,则Q1=(1-n)Q、Q2=nQ,整理得Q=Q1+Q2,故1mol CH3OH,则放出(Q1+Q2)kJ热量,故e正确;故答案为:ade;
②反应前后气体总质量不变,同温、同压下,达到平衡时,平衡时混合气体密度是同温同压下起始时的1.6倍,即气体密度增大,故平衡向气体体积缩小方向即向正反应方向移动,故答案为:正。


科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.能与酸反应的氧化物,一定是碱性氧化物
C.含金属元素的离子不一定都是阳离子
D.金属阳离子被还原后,一定得到该元素的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某酸H2A在水中存在下列电离:①H2A=H++HA- ②HA- ![]() H++A2- , 下列说法一定正确的是( )
H++A2- , 下列说法一定正确的是( )
A.Na2A溶液中一定有:c(OH-)= c(H+)+c(HA-)
B.Na2A溶液呈碱性,NaHA溶液可能酸性可能呈碱性
C.Na2A溶液中一定有c(Na+)+c(H+)= c(OH-)+c(A2-) +c(HA-)
D.NaHA溶液一定有c(Na+)>c(HA) >c(OH-)>c(H2A) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钼(MoS2) 被誉为“固体润滑剂之王”,利用低品质的辉钼矿( 含MoS2、SiO2以及CuFeS2等杂质) 制备高纯二硫化钼的一种生产工艺如下:
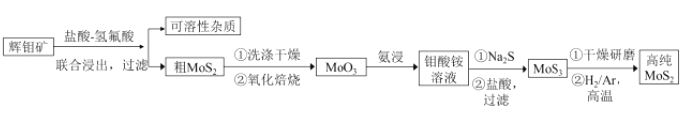
回答下列问题:
(1)钼酸铵的化学式为(NH4)2MoO4,其中Mo的化合价为________.
(2)利用联合浸出除杂时,氢氟酸可除去的杂质化学式为________如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式________。
(3)加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式____________。
(4)由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是___________。
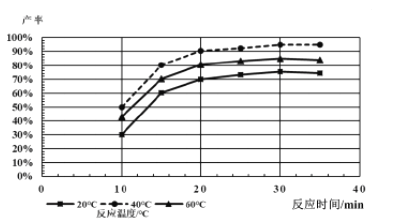
利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因:__________。
(5)高纯MoS2中3然会存在极微量杂质,如非整比晶体MoS2.8,则该杂质中Mo4+与Mo6+的物质的量之比为________________。
(6)已知Ksp(BaSO4) =1.1×10-10,Ksp(BaMoO4)=4.0×10-8),钼酸钠品体( NaMoO4·2H2O) 是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的c(MoO42-)/c(SO42-)___________(结果保留2位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将1.0mol/L 盐酸滴入20mL 10mol/L氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示。下列有关说法正确的是
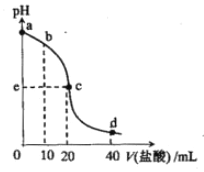
A. a点,c(NH4+)=c(OH-)
B. b点,c(NH4+)>c(Cl-)>c(NH3·H2O)
C. c点,pH=7
D. d点,c(NH4+)+c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】了解有机物分子中化学键特征以及成键方式是研究有机物性质的基础。下列关于有机物分子的成键方式的描述不正确的是( )
A. 烷烃分子中碳原子均采用sp3杂化轨道成键
B. 炔烃分子中碳碳叁键由1个σ键、2个π键组成
C. 甲苯分子中所有碳原子均采用sp2杂化轨道成键
D. 苯环中存在6个碳原子共有的大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合全部正确的是
编组 | 强电解质 | 弱电解质 | 非电解质 |
A | 氯化钠 | 水 | 氯气 |
B | 硫酸 | 碳酸钙 | 四氯化碳 |
C | 氯化银 | HD | 蔗糖 |
D | 氢氧化钡 | 次氯酸 | 乙醇 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硫的化合物在生产生活中的应用非常广泛。
(1)用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)![]() S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
S(g)+2CO2(g) ΔH1=+8.0 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH2=-566.0 kJ·mol-1
2CO2(g) ΔH2=-566.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH3=-483.6kJ·mol-1
2H2O(g) ΔH3=-483.6kJ·mol-1
则2H2(g)+SO2(g)![]() S(g)+2H2O(g) ΔH4=__________。
S(g)+2H2O(g) ΔH4=__________。
(2)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
C2H4(g)+4H2O(g)△H。在0.1MPa时,按n(CO2):n(H2)=1:3投料,如图所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
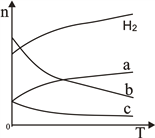
①该反应为____反应(填“吸热”或“放热”)。
②曲线c表示的物质为____________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是________【要求答2条】。
④恒温恒容下,能够说明该反应已达到平衡的是_______(填序号);
A.容器内的压强不发生变化
B.混合气体的密度不发生变化
C.n(CO2):n(H2):n(C2H4):n(H2O)=2:6:1:4
D.单位时间内生成6molH2,同时生成4 molH2O
(3)欲用1 L Na2CO3溶液将6.99gBaSO4固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为_________________。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。
(4)在25℃时,将a mol·L-1的氨水溶液与0.02 mol·L-1HCl溶液等体积混合后溶液液呈中性,则氨水的电离平衡常数Kb=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com