
分析 13号元素为铝元素,原子核内的质子数是13;铝与氢氧化钠溶液反应反应物为铝和氢氧化钠、水;金属铝和盐酸之间反应生成氯化铝和氢气.
解答 解:13号元素为铝元素,原子核内的质子数是13,原子结构示意图为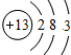 ;铝与氢氧化钠溶液化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;金属铝和盐酸之间反应生成氯化铝和氢气2Al+6HCl=2AlCl3+3H2↑,离子方程式2Al+6H+=2Al3++3H2↑,故答案为:
;铝与氢氧化钠溶液化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;金属铝和盐酸之间反应生成氯化铝和氢气2Al+6HCl=2AlCl3+3H2↑,离子方程式2Al+6H+=2Al3++3H2↑,故答案为: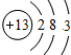 ;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;2Al+6H+=2Al3++3H2↑.
;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;2Al+6H+=2Al3++3H2↑.
点评 本题考查根据微粒结构示意图的含义、离子方程式的书写及有关知识的理解与掌握,题目难度不大,并能在解题中灵活应用的能力.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 CH3COOCH2CH3+H2O,用饱和碳酸钠溶液(填药品名称) 收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和碳酸钠溶液(填药品名称) 收集粗产品,用分液(填操作名称)的方法把粗产品分离.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
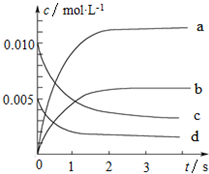 800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.
800℃时,在2L的密闭容器中发生反应:2NO(g)+O2(g)?2NO2,n(NO)随时间的变化如表所示.| 时间∕s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)∕mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
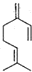 已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )
已知1,3-丁二烯结构中,两个碳碳双键中相隔一个单键,像具有这样结构的烯烃称为共轭二烯烃,加成时可以发生1,2加成和1,4加成,β-月桂烯的结构如图所示,一分子该物质与两分子溴发生加成反应的产物(不考虑顺反异构)理论上最多有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌-锰干电池中锌筒为正极,石墨棒为负极 | |
| B. | 锌-锰干电池即使不用,放置过久,也会失效 | |
| C. | 锌-锰干电池工作时,电流方向是由锌筒经外电路流向石墨棒 | |
| D. | 锌-锰干电池可实现化学能向电能和电能向化学能的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和乙烯 | B. | 乙烷和乙烯 | C. | 甲烷和乙烯 | D. | 甲烷和丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 乙$\stackrel{NaHCO_{3}}{→}$丙(C13H9O2Na)
乙$\stackrel{NaHCO_{3}}{→}$丙(C13H9O2Na) .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com