
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂-空气电池如图所示。当电池工作时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是

A.锂电极发生还原反应
B.多孔碳材料电极为正极
C.电池工作时外电路电子由多孔碳材料电极流向锂电极
D.正极的电极反应式为:O2+4e-+2H2O====4OH-
【答案】B
【解析】
A.由锂-空气电池示意图可知,锂电极为原电池的负极,锂失去电子发生氧化反应生成锂离子,故A错误;
B.得到电子的一极为原电池的正极,由氧元素化合价的变化可知,通入氧气的多孔碳材料电极为原电池的正极,氧气在正极上得到电子发生还原反应生成Li2O2-x,故B正确;
C.电池工作时外电路电子由负极流向正极,由锂-空气电池示意图可知,锂电极为原电池的负极,通入氧气的多孔碳材料电极为原电池的正极,则电子由锂电极流向多孔碳材料电极,故C错误;
D.由氧元素化合价的变化可知,通入氧气的多孔碳材料电极为原电池的正极,氧气在正极上得到电子发生还原反应生成Li2O2-x,电极反应式为:(2-x)O2+4e-+ 4Li+=2 Li2O2-x,故D错误;
故选B。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】科学家制造出一种使用固态电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作为惰性电极,在电极上分别通入CH4和空气,其中固态电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导O2-(O2+4e-=2O2-)。
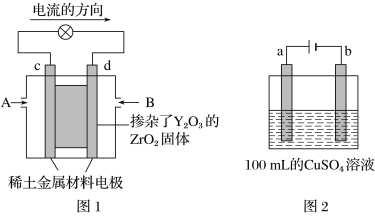
(1)c电极的名称为________(填“正极”或“负极”),d电极上的电极反应式为: ____。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为: __________,若a电极产生56 mL(标准状况)气体,则所得溶液的c(H+)=________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入________(填字母)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、D、E、F是原子序数依次增大的六种常见元素。E的单质在Z2中燃烧的产物可使品红溶液褪色。F和Z元素形成的化合物F3Z4具有磁性。X的单质在Z2中燃烧可生成XZ和XZ2两种气体。D的单质是一种金属,该金属在XZ2中剧烈燃烧生成黑、白两种固体。请回答下列问题:
(1)F元素在周期表中的位置是________,Y的单质分子的结构式为__________,DZ的电子式为________,DZ化合物中离子半径较大的是________(填离子符号)。
(2)X元素形成的同素异形体的晶体类型可能是________(填序号)。
①原子晶体 ②离子晶体 ③金属晶体 ④分子晶体
(3)X、Y、Z形成的10电子氢化物中,X、Y的氢化物沸点较低的是(写化学式):__________;Y、Z的氢化物分子结合H+能力较强的是(写化学式)________。
(4)下列可作为比较D和Na金属性强弱的依据是________。(填序号)
a.测两种元素单质的硬度和熔、沸点
b.比较两元素最高价氧化物对应的水化物溶液的碱性强弱
c.比较两种元素在氯化物中化合价的高低
d.比较单质与同浓度盐酸反应的剧烈程度
(5)Y的氢化物和Z的单质在一定条件下反应生成Z的氢化物(产物之一),该反应的方程式为___________。
(6)有人建议将氢元素排在元素周期表的ⅣA族,请你从化合价的角度给出一个理由__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,正确的是( )
A.在晶体中只要有阳离子就一定有阴离子
B.离子晶体中只有离子键没有共价键,分子晶体中只有分子间作用力没有共价键
C.分子晶体中分子间作用力越大,分子越稳定
D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10L的密闭容器中充入1mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
Z(g),60s后反应达到平衡,生成Z的物质的量为0.3mol。下列说法正确的是
A.X的平衡转化率为40%
B.若将容器体积变为20L,则Z的平衡浓度小于原来的![]()
C.若增大压强,则Y的平衡转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
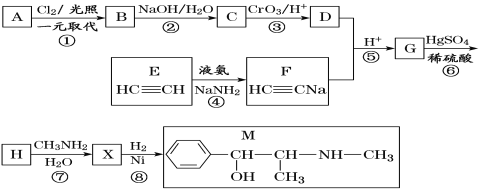
已知:I.R—CH2OH![]() RCHO
RCHO
II.R1-CHO+R-C≡CNa![]()
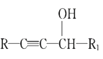
IV.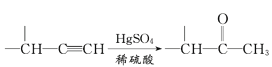
V.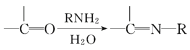
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)![]() H<0,向某体积恒定的密闭容器中按体积比2:1充入SO2和O2在一定条件下发生反应(纵坐标Y表示SO3的浓度)。下列说法正确的是
H<0,向某体积恒定的密闭容器中按体积比2:1充入SO2和O2在一定条件下发生反应(纵坐标Y表示SO3的浓度)。下列说法正确的是

A.T1>T2
B.平衡时,SO2的生成速率等于SO3的生成速率
C.当混合气体密度不变时,说明反应达到了平衡状态
D.当c(SO2):c(O2):c(SO3)=2:1:2时,说明反应达到了平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出正丁烷的结构简式:___________;写出漂白粉有效成分的化学式:__________。
(2)写出镁条和氮气反应的化学方程式_____________________________________。写出铁和氯化铁溶液反应的离子方程式___________________________________。写出乙烯和水反应的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃0.01mol·L-1w溶液中,![]() 。上述物质的转化关系如图所示。下列说法正确的是
。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小:a<b<c<d B. 氢化物的沸点:b>d
C. x的电子式为:![]() D. y、w含有的化学键类型完全相同
D. y、w含有的化学键类型完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com