
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示,H+、O2、NO3-等共存物会影响修复效果。下列说法错误的是

A.反应①②③④均为还原反应
B.1mol三氯乙烯完全脱Cl时,电子转移为3mol
C.④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D.修复过程中可能产生Fe(OH)3
【答案】B
【解析】
A. 由修复过程示意图中反应前后元素化合价变化可知,反应①②③④均为得电子的反应,所以均为还原反应,A项正确;
B. 三氯乙烯C2HCl3中C原子化合价为+1价,乙烯中C原子化合价为-2价,1 mol C2HCl3转化为1 molC2H4时,得到6 mol电子,B项错误;
C. 由示意图及N元素的化合价变化可写出如下转化NO3- + 8e- → NH4+,由于生成物中有NH4+所以只能用H+和H2O来配平该反应,而不能用H2O和OH-来配平,所以 ④的电极反应式为NO3-+10H++8e-=NH4++3H2O,C项正确;
D. ZVI 失去电子有Fe2+产生,Fe2+在氧气和OH-的作用下,可能产生Fe(OH)3,D项正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d均为石墨电极,通电进行电解,下列说法正确的是( )

A. 电路中电子流向:负极→d→c→b→a→正极
B. a、c两极产生气体的物质的量相等
C. SO42-向b电极运动,Cl-向c电极运动
D. 通电后乙烧杯滴入酚酞溶液d极会变红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,有强还原性。已知:①2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,②H3PO2+NaOH(足量)=NaH2PO2+H2O。下列推断不正确的是
A. H3PO2的结构式为
B. H3PO2具有强还原性,在空气中可能被氧化成磷酸
C. NaH2PO2是酸式盐
D. 每消耗1mol P4,反应①中转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个化学过程的示意图,请回答下列问题:
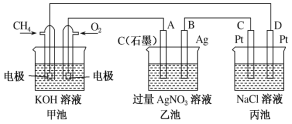
(1)图中甲池是____________装置,乙池是______________装置。
(2)D电极的名称是______________,A电极的名称是_______________。
(3)通入O2的电极的电极反应式为___________,通入CH4的电极的电极反应式为_________。
(4)丙池中反应的化学方程式为__________________。
(5)当乙池中B(Ag)极的质量增加4.32g时,甲池中理论上消耗O2______________________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热密闭容器中发生CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是
2N2(g)+CO2(g)+2H2O(g),下列情况都能说明该反应已达到平衡状态的是
①容器内混合气体的平均相对分子质量不再变化;
②容器内气体分子个数不再发生变化;
③容器内气体的压强不再发生变化;
④v正(NO):v逆(N2):V逆(CO2)=4:2:1
A.①②③B.③④C.①②③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是二元弱酸,NaHC2O4溶液呈酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系错误的是( )
A.V(NaOH) = 0时,c(H+) >1×10-7mol/L
B.V(NaOH)<10 mL时,可能存在c(Na+) = 2c(C2O42-)+c(HC2O4- )
C.V(NaOH) = 10 mL时,溶液的pH为9,则10-9= 10-5-2c(H2C2O4)-c(HC2O4-)
D.V(NaOH)>10 mL时,可能存在c(OH- )>c(Na+)>c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:
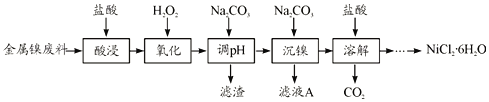
下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为Lil晶体锂电池的工作示意图,该电池具有使用寿命长、电压稳定等优点,常用于心脏起搏器的电源。下列说法错误的是( )
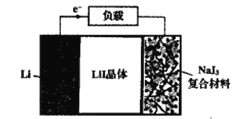
A.NaI3为电池的正极材料
B.电池工作时,Li+由NaI3移动到Li电极
C.正极电极反应为:2Li++NaI3+2e-=2LiI+NaI
D.该电池的总反应为:2Li+NaI3=2LiI+NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期包含18种元素,其中多种元素具有重要的用途,在现代工业中备受青睐。
(l)铁位于元素周期表____区,Fe3+的价电子排布式为 ____。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,可用en代表,其能够与Cu2+形成稳定环状配离子,可表示为[Cu(en)2]2+,其中Cu2+的配位数为____。1 mol[Cu(en)2]C12中含有σ键的数目为____。
(3)气态SeO3为单分子,该分子中Se原子的杂化轨道类型为 ___。用物质结构理论解释H2SeO4比H2SeO3酸性强的原因:______________。
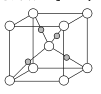
(4)如图为Cu2O的晶胞结构,其中黑球表示____原子(填元素符号);Cu2O的密度为pg·cm-3则晶胞的边长为 ___cm。(用NA表示阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com