
 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
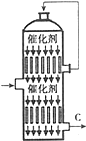
分析 (1)工业制硫酸是在沸腾炉中燃烧黄铁矿,黄铁矿的主要成分是FeS2,在氧气中燃烧得到SO2和Fe2O3;
(2)接触室发生的反应为2SO2(g)+O2(g)?△2SO3(g)△H<0,升高温度平衡逆向移动,反应物的转化率降低,从图表中可以看出,恒温时增大压强平衡正向移动,但反应物的转化率变化幅度不大,但压强的增大消耗能源及对设备的要求也高,故不易高压,综合考虑可选择适宜温度和压强;
(3)接触室发生的反应为2SO2(g)+O2(g)?△2SO3(g)△H<0,反应放出的热量会使容器内温度升高,促进平衡逆向移动,不易提高反应的转化率,故通过热交换器对反应降温,转移能量给反应物加热;从C处排出的尾气主要含有SO2和SO3,其中SO3能和BaCl2溶液反应生成白色沉淀,SO2不能与反应,原因是弱酸不能制强酸;
(4)矿石粉碎后有利于硫元素尽可能多转化为SO2及提高反应速率,a正确;氧气过量可提高SO2的转化率,b正确;余热发电或供暖可“变废为宝”,c正确;废液处理会导致投入增加,d错误;
(5)①由于运送硫酸的成本远高于运送矿石的成本,故硫酸工厂应该接近消耗中心的地方;又因为硫酸属于重污染工业,故应建在远离风景名胜区,人口稠密的地方;②C与CaSO4是反应物,生成物是CO与CaS,由此可写出对应的化学方程式;
(6)化学变化过程中遵守原子守恒①,可以先计算出等质量的硫磺和FeS2的物质的量之比,即可计算出生成硫酸的物质的量比及硫酸的质量比.
解答 解:(1)工业制硫酸是利用黄铁矿在沸腾炉中燃烧生成二氧化硫,然后在接触室催化氧化二氧化硫得三氧化硫,最后吸收塔用98%的浓硫酸吸收SO3,其中黄铁矿燃烧反应方程式为4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,故答案为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;沸腾炉;
(2)从图中可看出恒压条件下升高温度,SO2的转化率降低,因此选择低温400℃,在恒温条件下增大压强,SO2的转化率增大幅度较小,考虑到产生高压会消耗能源及对设备的要求较高,因此选择较低压强为宜,故答案为:1个大气压、400℃;
(3)在接触室内通过热交换转移反应放出的热量,给容器降温,促进平衡正向移动提高SO2的转化率,另外通过热交换可以给反应物预热,有利于反应进行;从C处排出的尾气主要含有SO2和SO3,通过BaCl2溶液时,SO3能和BaCl2溶液反应生成BaSO4沉淀,SO2不能被吸收,发生反应的离子方程式为SO3+Ba2++H2O=BaSO4↓+2H+,故答案为:预热原料气,吸收反应放出的热量;SO3+Ba2++H2O=BaSO4↓+2H+;
(4)a.粉碎黄铁矿增大反应接触面积,有利于提高硫原子利用率,a正确;
b.在接触室中使用适当过量的O2,可提高SO2的转化率,对提高硫酸的产量有利,b正确;
c.通过热交换可将反应产生的热量转移出来用于余热发电或供暖,提高经济效益,c正确;
d.对废水进行无害化处理后再排放,避免环境污染,但增加了经济反投入,d错误;
故答案为:d;
(5)①工业制硫酸选择厂址时要考虑原料的运输成本,因尾气对环境有影响应尽量避免对居民的生活影响,减少对名胜古迹的损害,综合考虑B地完全符合条件,适宜建厂;②焦炭将CaSO4转化为CaS和另有一种可燃性气体生成,结合化学反应的本质,可知此气体是CO,发生反应的化学方程式为CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO↑;故答案为:①B地远离硫酸的消耗中心,B地远离人品稠密的地方,B地不发球风景名胜区;②CaSO4+4C$\frac{\underline{\;高温\;}}{\;}$CaS+4CO↑;
(6)已知n=$\frac{mg}{Mg/mol}$,可知等质量的硫磺和FeS2的物质的量之比与二者摩尔质量之比成反比,则硫磺和FeS2的物质的量之比为$\frac{120g/mol}{32g/mol}=\frac{15}{4}$,在制备硫酸的过程中遵守硫原子守恒,且生成硫酸的质量比等于物质的量之比为$\frac{15}{4×2}$=15:8;故答案为:15:8.
点评 硫酸工业制法,考查氧化还原理论,化学平衡的移动,原子守恒等知识点,对学生的基础要求比较强,属中等难度.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 |
| 完全沉淀的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米碳管是一种新型的高分子化合物 | |
| B. | 纳米碳管的化学性质稳定 | |
| C. | 纳米碳管的结构和性质与金刚石相同 | |
| D. | 纳米碳管导电属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个OH-含有电子10mol | |
| B. | 某元素R一个原子的质量是ag,则其的相对原子质量可表示为a NA | |
| C. | 4L0.5mol/L的NaOH溶液中含有阴离子的数目为2NA | |
| D. | 配制一定物质的量浓度的NaOH溶液时,定容时俯视操作所得溶液浓度偏低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com