
| A. | LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 | |
| B. | LiAlH4与D2O反应,所得氢气的摩尔质量为4 g•mol-1 | |
| C. | 1 mol LiAlH4在125℃完全分解,转移3 mol电子 | |
| D. | LiAlH4与水反应生成三种物质时,化学方程式可表示为:LiAlH4+4H2O═Al(OH)3↓+LiOH+4H2↑ |
分析 A.乙醛变化为乙醇的过程是加氢反应,是乙醛被还原发生还原反应;
B.LiH与D2O反应生成的氢气分子式为HD;
C.依据LiAlH4在125℃分解为LiH、H2和Al的化学方程式计算;
D.LiAlH4中的-1价H与H2O中的+1价H发生氧化还原反应生成H2,同时生成OH-,OH-与Al3+反应生成AlO2-.
解答 解:A.乙醛变成乙醇得到氢,在有机中得氢去氧是还原,所以氧化剂是乙醛,LiAlH4是还原剂,故A正确;
B.LiH与D2O反应生成氢气(HD),其摩尔质量为3 g/mol,故B错误;
C.LiAlH4中的Li、Al都是主族金属元素,H是非金属元素,故Li为+1价、Al为+3价、H为-1价,受热分解时,根据Al元素的价态变化即可得出1 mol LiAlH4在125℃时完全分解,转移3 mol电子,故C正确;
D.LiAlH4中的-1价H与H2O中的+1价H发生氧化还原反应生成H2,同时生成OH-,OH-与Al3+反应生成AlO2-,则反应的化学方程式为LiAlH4+2H2O=LiAlO2+4H2↑,故D正确;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意电子转移的计算,题目难度不大.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液呈橙色不分层 | B. | 溶液分两层,上层呈橙色 | ||
| C. | 溶液分两层,下层呈橙色 | D. | 溶液呈紫色不分层 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 甲 组 | 乙 组 | ||
| 实验步骤 | 实验现象 | 实验步骤 | 实验现象 |
| 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. | 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. |
| 2.取一小块铝和一小块镁带,用砂纸擦去表面的氧化膜,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:剧烈反应,很快产生大量气体. 铝:也产生大量气体,但反应比镁慢. | 2.取一小块铝和一小块镁带,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:开始时没有现象,过一会儿产生大量气体. 铝:基本没有变化. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
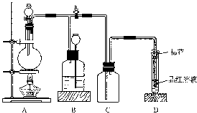 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑤ | C. | ①③④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g SO2含有氧原子数为NA | |
| B. | 物质的量浓度为0.5mol/LAl2(SO4)3溶液,含有SO42-离子数为1.5NA | |
| C. | 标准状况下,22.4 LSO3的分子数为NA | |
| D. | 常温常压下,14 g N2含有分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+O2(g)→CO2(g)+393kJ | B. | C+O2→CO2+393kJ | ||
| C. | C(s)+O2(g)→CO2(g)-393kJ | D. | C(s)+1/2O2(g)→CO(g)+393kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com