
分析 (1)正常的雨中因为溶有二氧化碳,其pH=5.6,二氧化硫形成的酸雨中含有亚硫酸,易被空气中氧气氧化成硫酸;
(2)根据铜与稀硝酸及浓硝酸反应的方程式可知,溶解等质量的铜,使用稀硝酸时消耗的硝酸少,且产生的有害气体也少;
(3)用SiCl4、N2和H2在一定条件下反应生成氮化硅,根据元素守恒可知,还有生成HCl,据此书写化学方程式.
解答 解:(1)正常的雨中因为溶有二氧化碳,其pH=5.6,所以硫酸型酸雨的pH<5.6,二氧化硫形成的酸雨中含有亚硫酸,易被空气中氧气氧化成硫酸,溶液的酸性增强,
故答案为:<;雨水中的亚硫酸被氧气氧化成硫酸,酸性增强;
(2)铜与稀硝酸及浓硝酸反应的方程式为Cu+4HNO3(浓)═Cu(NO3)+2NO2↑+2H2O,3Cu+8HNO3(浓)═3Cu(NO3)+2NO↑+4H2O,根据方程式可知,溶解等质量的铜,使用稀硝酸时消耗的硝酸少,且产生的有害气体也少,故用稀硝酸好,
故答案为:溶解等质量的铜,使用稀硝酸时消耗的硝酸少,且产生的有害气体也少,故用稀硝酸好;
(3)用SiCl4、N2和H2在一定条件下反应生成氮化硅,根据元素守恒可知,还有生成HCl,反应的化学方程式为SiCl4+N2+H2→Si3N4+HCl,
故答案为:SiCl4+N2+H2→Si3N4+HCl.
点评 本题考查与生活和实际相关的反应的方程式的书写,涉及氧化还原反应,题目难度不大,把握氧化还原反应原理为解答的关键,侧重于考查学生的分析能力和对基础知识的应用能力.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
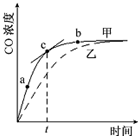 氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:
氮化铝(AlN)是一种人工合成的非氧化物陶瓷材料,可在温度高于1500℃时,通过碳热还原法制得.实验研究认为,该碳热还原反应分两步进行:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
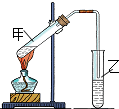 (1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:
(1)“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置由乙醇、乙酸和浓硫酸来制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在任何条件下,化学平衡常数都是一个定值 | |
| B. | 化学平衡常数K可以推断一个可逆反应进行的程度 | |
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强有关 | |
| D. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是固体,C是气体,正反应吸热 | B. | A是气体,C是气体,正反应放热 | ||
| C. | A是气体,C是固体,正反应放热 | D. | A是气体,C是气体,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
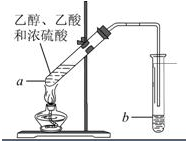 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯.在实验室也可以用如图所示的装置制取乙酸乙酯,请回答下列问题.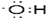
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
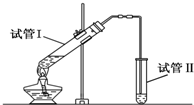 实验室用如图所示装置制备少量乙酸乙 酯.
实验室用如图所示装置制备少量乙酸乙 酯.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾离子结构示意图: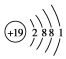 | |
| B. | KNO3溶液中,H+、Na+、Br-、I-能大量共存 | |
| C. | 可用于生产复合肥、配制炸药和制造瓷釉彩药 | |
| D. | KNO3溶液中混有少量NaCl时,可用重结晶的方法提纯,原因是KNO3溶解度大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com